Химия кислород в природе. Образование кислорода в природе и получение его в технике. Кислород: история открытия
Кислород – химический элемент VI группы периодической системы Менделеева и самый распространенный элемент в земной коре (47% от ее массы). Кислород является жизненно важным элементом почти всех живых организмов. Более подробно о функциях и применении кислорода в этой статье.
Общие сведения
Кислород представляет собой бесцветный газ без вкуса и запаха, который плохо растворяется в воде. Он входит в состав воды, минералов, горных пород. Свободный кислород образуется благодаря процессам фотосинтеза. Кислород играет наиважнейшую роль в жизни человека. Прежде всего кислород необходим для дыхания живых организмов. Также он принимает участие в процессах разложения погибших животных и растений.
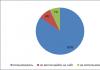
Воздух содержит около 20,95% по объему кислорода. В гидросфере содержится почти 86% по массе кислорода.
Кислород был получен одновременно двумя учеными, но сделали они это независимо друг от друга. Швед К. Шееле получил кислород при прокаливании селитры и других веществ, а англичанин Дж. Пристли – при нагревании оксида ртути.

Рис. 1. Получение кислорода из оксида ртути
Применение кислорода в промышленности
Области применения кислорода обширны.
В металлургии он необходим для производства стали, которую получают из металлолома и чугуна. Во многих металлургических агрегатах для лучшего сжигания топлива используют воздух, обогащенный кислородом.
В авиации кислород используется как окислитель топлива в ракетных двигателях. Также он необходим для полетов в космос и в условиях, где нет атмосферы.
В области машиностроения кислород очень важен для резки и сварки металлов. Чтобы расплавить металл нужна специальная горелка, состоящая из металлических труб. Эти две трубы вставляются друг в друга. Свободное пространство между ними заполняют ацетиленом и зажигают. Кислород же в это время пускают по внутренней трубке. И кислород и ацетилен подаются из баллона под давлением. Образуется пламя, температура в котором достигает 2000 градусов. При такой температуре плавится практически любой металл.

Рис. 2. Ацетиленовая горелка
Применение кислорода в целлюлозно-бумажной промышленности очень важно. Он используется для отбеливания бумаги, при спиртовании, при вымывании лишних компонентов из целлюлозы (делигнификация).
В химической промышленности кислород используется в качестве реагента.
Для создания взрывчатых веществ необходим жидкий кислород. Жидкий кислород производится путем сжижения воздуха и последующего отделения кислорода от азота.
Применение кислорода в природе и жизни человека
Кислород играет наиважнейшую роль в жизни человека и животных. Свободный кислород существует на нашей планете благодаря фотосинтезу. Фотосинтез – это процесс образования органического вещества на свету с помощью углекислого газа и воды. В результате этого процесса образуется кислород, который необходим для жизнедеятельности животных и человека. Животные и человек потребляют кислород постоянно, растения же расходуют кислород только ночью, а днем производят его.
Применение кислорода в медицине
Кислород находит применение и в медицине. Особенно актуально его использование при затрудненном дыхании во время некоторых заболеваний. Он применяется для обогащения дыхательных путей при туберкулезе легких, а также используется в наркозной аппаратуре. Кислород в медицине используется для лечения бронхиальной астмы, болезней желудочно-кишечного тракта. Для этих целей используют кислородные коктейли.
Также большое значение имеют кислородные подушки – прорезиненная емкость, заполненная кислородом. Она служит для индивидуального применения медицинского кислорода.

Рис. 3. Кислородная подушка
Что мы узнали?
В данном сообщении, которое охватывает тему «Кислород» по химии 9 класса кратко даны общие сведения о свойствах и применении этого газа. Кислород крайне важен для машиностроения, медицины, металлургической области и т.д.
Тест по теме
Оценка доклада
Средняя оценка: 4.6 . Всего получено оценок: 369.
Легкий газ кислород - самый распространенный на Земле элемент. В земной коре его по весу в 12 раз больше, чем железа, в 140 раз больше, чем углерода, почти в 500 раз больше, чем серы; он составляет 49,13 процента от веса всей земной коры.
Такое распространение кислорода на Земле полностью отвечает его значению в жизни живой и мертвой природы. Ведь вода - это соединение водорода с кислородом (содержит 89 процентов кислорода), песок - соединение кремния с кислородом (53 процента кислорода), железная руда - соединение железа с кислородом. Кислород входит в состав многих руд и минералов. Но наибольшее значение имеет кислород для жизни живой природы, для жизни животных и человека. Без кислорода жизнь на Земле невозможна.
Вся жизнедеятельность человеческого организма, начиная с рождения и кончая смертью, связана с окислительными процессами, в которых главную роль играет кислород.
Эти процессы начинаются с дыхания человека. Вдыхаемый человеком воздух поступает в легкие. Здесь через стенки тончайших кровеносных сосудов, через которые не проходит жидкость, но проходит газ, кислород проникает в кровь. В крови происходит важнейший для жизни процесс газообмена.
Кровь, поглощая кислород, выделяет содержащийся в ней углекислый газ. Обычно воздух содержит 0,03 процента углекислого газа, выдыхаемый же человеком воздух имеет в своем составе 4,38 процента углекислого газа.
Таким образом, содержание углекислого газа в выдыхаемом человеком воздухе увеличивается в 140 раз по сравнению с его содержанием в воздухе. Содержание же кислорода, наоборот, падает до 16,04 процента, то есть на 1/5 по сравнению с его содержанием в воздухе.
Полученный кровью кислород разносится по всему телу и окисляет растворенные в ней питательные вещества. При окислении кислородом, то есть при медленном сгорании питательных веществ, поступающих в организм, образуется углекислый газ, который поглощается циркулирующей кровью. Углекислый газ кровью приносится к легким и здесь, при новом газообмене с поступившим свежим кислородом воздуха, при выдыхании выбрасывается в окружающую атмосферу.
Взрослый человек ежедневно поглощает в процессе дыхания примерно 850 литров кислорода. Окислительные процессы, идущие в нашем организме, сопровождаются выделением тепла. Это тепло, связанное с процессом дыхания, и поддерживает температуру нашего тела на уровне примерно 37 градусов.
При дыхании, при горении, при любых других окислительных процессах (ржавление металлов, гниение и т. д.) идет поглощение кислорода воздуха. Могут возникнуть законные вопросы: не беднеет ли воздух кислородом, надолго ли его хватит для жизни на Земле? Для беспокойств в этом отношении нет повода.
В атмосфере содержится 1 300 000 000 000 000 тонн кислорода, и хотя эта величина составляет лишь одну десятитысячную общего содержания кислорода в земной коре, это число достаточно велико. Но самое главное заключается в том, что оно практически не изменяется благодаря идущим в природе обратным процессам выделения кислорода.
Эти процессы выделения кислорода происходят в результате жизнедеятельности растений. Поглощая из воздуха углекислый газ для своего питания, растения под действием солнечных лучей разлагают его на углерод и кислород. Углерод остается в растении и идет на построение его организма, кислород же выделяется обратно в атмосферу. И хотя растения также дышат, и им для дыхания необходим кислород, но в общем то количество кислорода, которое растения выделяют при своем питании, в 20 раз больше того, которое им необходимо для дыхания. Таким образом, растения - это живые фабрики кислорода.
Вот почему посадки растений в городах имеют большое оздоровительное значение. Они не только поглощают избыточные количества углекислого газа, накопляющегося здесь в результате действия фабрик и заводов, но, содействуя очистке воздуха от вредных примесей, они обогащают его живительным для организма человека и животных кислородом.
Зеленое кольцо вокруг городов-это источник кислорода, источник здоровья.
Лекция «Кислород – химический элемент и простое вещество »
План лекции:
1. Кислород – химический элемент:
в) Распространённость химического элемента в природе
2. Кислород – простое вещество
а) Получение кислорода
б) Химические свойства кислорода
в) Круговорот кислорода в природе
г) Применение кислорода
«Dum spiro spero
» (Пока дышу, надеюсь...), - гласит
латынь
Дыхание – это синоним жизни, а источник жизни на Земле – кислород.
Подчёркивая важность кислорода для земных процессов, Яков Берцелиус сказал: « Кислород – это вещество, вокруг которого вращается земная химия»Материал данной лекции обобщает ранее полученные знания по теме «Кислород».
1. Кислород – химический элемент
а) Характеристика химического элемента – кислорода по его положению в ПСХЭ

Кислород - элемент главной подгруппы шестой группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным порядковым номером 8. Обозначается символом O (лат. Oxygenium ). Относительная атомная масса химического элемента кислорода равна 16, т.е. Ar (O )=16.
б) Валентные возможности атома кислорода
В соединениях кислород обычно двухвалентен (в оксидах), валентность VI не существует.В свободном виде встречается в виде двух простых веществ: О 2 («обычный» кислород) и О 3 (озон). О 2 - газ без цвета и запаха, с относительной молекулярной массой =32. О 3 – газ без цвета с резким запахом, с относительной молекулярной массой =48.
Внимание! H 2 O 2 (перекись водорода) – O (валентность II)
СО (угарный газ) – О (валентность III)
в) Распространённость химического элемента кислорода в природе
Кислород - самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 49% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода - 85,5% (по массе), в атмосфере содержание свободного кислорода составляет 21% по объёму и 23% по массе. Более 1500 соединений земной коры в своем составе содержат кислород.
Кислород входит в состав многих органических веществ и присутствует во всех живых клетках. По числу атомов в живых клетках он составляет около 20 %, по массовой доле - около 65 %.
2. Кислород – простое вещество
а) Получение кислорода
Получение в лаборатории
1) Разложение перманганата калия (марганцовка):
2KMnO 4 t˚C =K 2 MnO 4 +MnO 2 +O 2
2) Разложение перекиси водорода:
2H 2 O 2 MnO2 =2H 2 O + O 2
3) Разложение бертолетовой соли:
2KClO 3 t˚C , MnO2 =2KCl + 3O 2
Получение в промышленности
1) Электролиз воды
2 H 2 O эл . ток =2 H 2 + O 2
2) Из воздуха
ВОЗДУХ давление, -183˚ C = O 2 (голубая жидкость)
В настоящее время в промышленности кислород получают из воздуха. В лабораториях небольшие количества кислорода можно получать нагреванием перманганата калия (марганцовка) KMnO 4 . Кислород мало растворим в воде и тяжелее воздуха, поэтому его можно получать двумя способами:
Доклад на тему «Применение кислорода» кратко изложенное в этой статье, расскажет Вам о сферах промышленности, в которых это невидимое вещество приносит невероятную пользу.
Сообщение о применении кислорода
Кислород является неотъемлемой частью жизнедеятельности всех живых организмов и химических процессов на планете. В этой статье мы рассмотрим наиболее частые области применения кислорода:
Применение кислорода в медицине
В данной области он чрезвычайно важен: химический элемент используется для жизненного поддержания людей, страдающих на затрудненное дыхание и для лечения некоторых недугов. Примечательно, что при нормальном давлении чистым кислородом дышать долго нельзя. Это небезопасно для здоровья.
Применение кислорода в стекольной промышленности
Данный химический элемент в стекловаренных печах используется в качестве компонента, улучшающего горение в них. Также благодаря кислороду промышленность уменьшает выбросы оксидов азота до уровня безопасных для жизни.
Применение кислорода в целлюлозно–бумажной промышленности
Данный химический элемент используется при спиртовании, делигнификации и в других процессах, таких как:
- Отбеливание бумаги
- Очистка сточных вод
- Подготовка питьевой воды
- Интенсификация горения мусоросжигательных печей
- Переработка покрышек
Применение кислорода в авиации
Поскольку человек не может дышать вне атмосферы без кислорода, то ему необходимо брать запас данного полезного элемента с собой. Искусственно полученный кислород используется людьми для дыхания в чуждой среде: в авиации при полетах, в космических аппаратах.
Применение кислорода в природе
В природе существует круговорот кислорода: в процессе фотосинтеза растения на свету превращают углекислый газ и воду в органические соединения. Данный процесс характеризуется выделением кислорода. Как человек и животные, растения в темное время суток потребляют кислород из атмосферы. Круговорот кислорода в природе определяется тем, что человек и животные потребляют кислород, а растения производят его днем и расходуют ночью.
Применение кислорода в металлургии
Для химической и металлургической промышленности нужен чистый кислород, а не атмосферный. В мире каждый год предприятия получают больше 80 млн. тонн данного химического элемента. Он израсходуется в процессе получения стали из металлолома и чугуна.
Какое применение кислорода в машиностроении?
В строительстве и машиностроении он используется для резки и сварки металлов. Данные процессы осуществляются при высоких температурах.
Применение кислорода в жизни
В жизни человек использует кислород в различных сферах, таких как:
- Выращивание рыбы в прудовых хозяйствах (вода насыщается кислородом).
- Обработка воды во время изготовления пищевых продуктов.
- Обеззараживание хранилищ и производственных помещений кислородом.
- Разработка кислородных коктейлей для животных, чтобы те прибавляли в весе.
Применение кислорода человеком в электроэнергии
Тепловые и электрические станции, которые работают на нефти, природном газе или угле, для сжигания топлива используют кислород. Без него все производственные промышленные заводы просто бы не работали.
Надеемся, что сообщение на тему «Применение кислорода» помогло Вам подготовиться к занятию. А рассказ о применении кислорода Вы можете дополнить через форму комментариев ниже.
С момента появления химии человечеству стало понятно, что все вокруг состоит из вещества, в состав которого входят химические элементы. Многообразие веществ обеспечивается различными соединениями простых элементов. На сегодня открыто и внесено в периодическую таблицу Д. Менделеева 118 химических элементов. Среди них стоит выделить ряд ведущих, наличие которых определило появление органической жизни на Земле. В этот перечень входят: азот, углерод, кислород, водород, сера и фосфор.
Кислород: история открытия
Все эти элементы, а также ряд других, способствовали развитию эволюции жизни на нашей планете в том виде, в котором мы сейчас наблюдаем. Среди всех компонентов именно кислорода в природе больше остальных элементов.
Кислород как отдельный элемент был открыт 1 августа 1774 года В ходе эксперимента по получению воздуха из окалины ртути путём нагревания при помощи обычной линзы он обнаружил, что свеча горит необычно ярким пламенем.
Долгое время Пристли пытался найти этому разумное объяснение. На тот момент этому явлению было дано название «второй воздух». Несколько ранее изобретатель подводной лодки К. Дреббель в начале XVII века выделил кислород и использовал его для дыхания в своём изобретении. Но его опыты не оказали влияния на понимание того, какую роль играет кислород в природе энергообмена живых организмов. Однако учёным, официально открывшим кислород, признан французский химик Антуан Лоран Лавуазье. Он повторил эксперимент Пристли и понял, что образующийся газ является отдельным элементом.
Кислород взаимодействует практически со всеми простыми и кроме инертных газов и благородных металлов.
Нахождение кислорода в природе
Среди всех элементов нашей планеты наибольшую долю занимает кислород. Распространение кислорода в природе весьма разнообразно. Он присутствует как в связанном виде, так и в свободном. Как правило, являясь сильным окислителем, он пребывает в связанном состоянии. Нахождение кислорода в природе как отдельного несвязанного элемента зафиксировано только в атмосфере планеты.

Содержится в виде газа и представляет собой соединение двух атомов кислорода. Составляет около 21 % от общего объёма атмосферы.
Кислород в воздухе, кроме обычной своей формы, имеет изотропную форму в виде озона. состоит из трёх атомов кислорода. Голубой цвет неба непосредственно связан с наличием этого соединения в верхних слоях атмосферы. Благодаря озону, жёсткое коротковолновое излучение от нашего Солнца поглощается и не попадает на поверхность.

В случае отсутствия озонового слоя органическая жизнь была бы уничтожена, подобно поджаренной еде в микроволновой печи.
В гидросфере нашей планеты этот элемент находится в связанном виде с двумя и образует воду. Доля содержания кислорода в океанах, морях, реках и подземных водах оценивается около 86- 89 %, с учётом растворенных солей.
В земной коре кислород находится в связанном виде и является наиболее распространённым элементом. Его доля составляет около 47 %. Нахождение кислорода в природе не ограничивается оболочками планеты, этот элемент входит в состав всех органических существ. Его доля в среднем достигает 67 % от общей массы всех элементов.
Кислород - основа жизни
Из-за высокой окислительной активности кислород достаточно легко соединяется с большинством элементов и веществ, образуя оксиды. Высокая окислительная способность элемента обеспечивает всем известный процесс горения. Кислород также участвует в процессах медленного окисления.
Роль кислорода в природе как сильного окислителя незаменима в процессе жизнедеятельности живых организмов. Благодаря этому химическому процессу происходит окисление веществ с выделением энергии. Её живые организмы используют для своей жизнедеятельности.
Растения - источник кислорода в атмосфере
На начальном этапе образования атмосферы на нашей планете существующий кислород находился в связанном состоянии, в виде двуокиси углерода (углекислый газ). Со временем появились растения, способные поглощать углекислый газ.

Данный процесс стал возможен благодаря возникновению фотосинтеза. Со временем, в ходе жизнедеятельности растений, за миллионы лет в атмосфере Земли накопилось большое количество свободного кислорода.
По мнению учёных, в прошлом его массовая доля достигала порядка 30 %, в полтора раза больше, чем сейчас. Растения, как в прошлом, так и сейчас, существенно повлияли на круговорот кислорода в природе, обеспечив тем самым разнообразную флору и фауну нашей планеты.
Значение кислорода в природе не просто огромно, а первостепенно. Система метаболизма животного мира чётко опирается на наличие кислорода в атмосфере. При его отсутствии жизнь становится невозможной в том виде, в котором мы знаем. Среди обитателей планеты останутся только анаэробные (способные жить без наличия кислорода) организмы.
Интенсивный в природе обеспечен тем, что он находится в трёх агрегатных состояниях в объединении с другими элементами. Будучи сильным окислителем, он очень легко переходит из свободной формы в связанную. И только благодаря растениям, которые путём фотосинтеза расщепляют углекислый газ, он имеется в свободной форме.
Процесс дыхания животных и насекомых основан на получении несвязанного кислорода для окислительно-восстановительных реакций с последующим получением энергии для обеспечения жизнедеятельности организма. Нахождение кислорода в природе, связанного и свободного, обеспечивает полноценную жизнедеятельность всего живого на планете.
Эволюция и «химия» планеты
Эволюция жизни на планете опиралась на особенности состава атмосферы Земли, состава минералов и наличия воды в жидком состоянии.

Химический состав коры, атмосферы и наличие воды стали основой зарождения жизни на планете и определили направление эволюции живых организмов.
Опираясь на имеющуюся «химию» планеты, эволюция пришла к углеродной органической жизни на основе воды как растворителя химических веществ, а также использовании кислорода как окислителя с целью получения энергии.
Иная эволюция
На данном этапе современная наука не опровергает возможность жизни в иных средах, отличных от земных условий, где за основу построения органической молекулы может быть взят кремний или мышьяк. А среда жидкости, как растворителя, может представлять собой смесь жидкого аммиака с гелием. Что касается атмосферы, то она может быть представлена в виде газообразного водорода с примесью гелия и других газов.
Какие метаболические процессы могут быть при таких условиях, современная наука пока не в состоянии смоделировать. Однако такое направление эволюции жизни вполне допустимо. Как доказывает время, человечество постоянно сталкивается с расширением границ нашего понимания окружающего мира и жизни в нем.