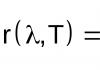Сопряженные системы. Виды сопряжения. Тема: Взаимное влияние атомов в молекулах органических соединений. Взаимное влияние атомов в молекуле и способы его передачи Влияние атомов в молекулах органических веществ
Взаимное влияние атомов в молекулах является важнейшим свойством органических соединений, отличающих их от простых неорганических соединений. Взаимное влияние, как результат взаимодействия соседних атомов, в органических молекулах передается по цепи a-связей С-С и особенно успешно по цепи сопряженных С-С-связей и определяет избирательность реакционных центров в молекуле к тем или иным реагентам. Ранее уже упоминалось о том, что реагенты подразделяются на электронодонорные (нуклеофильные) и электроноакцепторные (электрофильные). Следует также добавить, что они могут быть электрононейтральными, когда электронодонорные и электроноакцепторные свойства скомпенсированы или отсутствуют вовсе. Кроме того, следует различать реагенты свободнорадикальные (R* или R*), молекулярные и ионные. Классификация и свойства реагентов будут рассмотрены подробно позднее.
Взаимное влияние атомов вытекает уже из классической теории строения А.М. Бутлерова и было впервые сформулировано его учеником из Казанской школы химиков В. В. Марковниковым в его докторской диссертации «Материалы по вопросу о взаимном влиянии атомов в химических соединениях» (1869).
Впервые взаимное влияние атомов было обнаружено в молекулах алке- нов и галогенопроизводных алканов. Марковников установил, что алкены с несимметричной электронной оболочкой, например СН-СН=СН,
^С=СН 2 , / С=СН-СН 3 , присоединяют бромоводород таким
образом, что НВг отдает свой атом водорода к наиболее гидрогенизирован- ному (с максимальным числом Н-атомов) углероду:
Реакция практически не идет по второму маршруту
потому, что в 2-метилпропене проявляется индукционный электронный эффект метильных (алкильных) групп в отношении 4 / л - орбиталей. Индукционный эффект (/-эффект) обусловлен поляризацией а-электронного облака в цепи химических связей атомов, имеющих разную электроотрицательность.
Под поляризацией молекулы понимают перераспределение электронной плотности под действием электростатических сил, при котором происходит частичное разделение «центров тяжести» положительного и отрицательного зарядов. При этом к поляризации более склонны малополярные частицы (имеющие низкие электрические моменты диполей). При этом электроотрицательностью обладают не только атомы, но и атомные группировки. Алкильные группировки обладают по отношению к а,тг-орбиталям, т. е. атомам
С, находящимся в 5/? 2 -гибридном состоянии, электронодонорной способностью. В результате такого электронного воздействия алкильных групп связывающая 4^-орбиталь поляризована в сторону второго атома углерода.
Вследствис этого возникают дробные заряды С,=^-=- С 2 Такой эффект,
идущий с передачей а-электронной плотности на другие атомы, называется +/-эффектом, так как на СН 3 -группах возникает небольшой дробный заряд 6+. Поэтому полярная ковалентная молекула Н-Br ориентируется таким образом по отношению к я-связи, что в элементарном акте сначала возникает короткоживущее переходное состояние

которое превращается сначала в карбкатион (СН 3) 2 С-СН 3 и Вг~, а затем они быстро и легко рекомбинируют в (СН 3) 2 С(Вг)-СН 3 .
Можно также рассмотреть вопрос с точки зрения устойчивости образующегося в элементарном акте карбкатиона (наиболее энергетически выгодной делокализации положительного заряда в нем). Это более упрощенный подход, хотя суть опять же сводится к влиянию ±/-электронного эффекта, как причины устойчивости карбкатиона третичного по сравнению с первичным.
Кроме метальных и других алкильных групп +/-эффектом, т. е. способностью терять небольшую часть своей электронной плотности, обладают атомы металлов I - III групп периодической системы (Li, Са, А1 и др.), а также гидридные группировки (-SiH 3 , -РН 2 , -ВН 2 , -А1Н 2), их алкильные производные (-SiR 3 , -PR 2 , -BR 2 , -A1R 2 и др.).
Производные азота, кислорода и галогенов, обладающие более высокой электроотрицательностью, чем С-атомы, вызывают поляризацию, т. е. смещение электронной плотности а-электронов в сторону своих орбиталей и обладают отрицательным индукционным (-/) эффектом. Например, хлороформ СНС1 3 в отличие от метана обладает достаточно высокой протонодонорной способностью, так как с-орбиталь связи Н-СС1 3 сильно поляризована в сторону атомов хлора. Аналогично поляризующее действие трех атомов
хлора в СС1 3 СООН передается на связь О-Н трихлоруксусной кислоты, в результате связь О-Н настолько сильно поляризуется, что СС1 3 СООН в отличие от слабой уксусной кислоты СН 3 СООН становится сравнительно сильной кислотой. В этих примерах осуществляется как ближнее (СНС1 3), так и дальнее взаимное влияние более электроположительных или электроотрицательных атомов и их группировок на другие атомы, связанные с ними с помощью а- или я-орбиталей. Установлено, что ±/-эффект слабее передается по цепи ст-связей, практически затухая на пятом-шестом атоме углерода, тогда как сопряженная л-связь свободно передает ±/-влияние на конечный атом сопряженной цепи.
Механизм легкой передачи в л-системах ±/-эффекта не исследован. Можно допустить, что он обусловлен делокализацией л-электронов, их высокой подвижностью по всей сопряженной цепи л-электронов, в результате чего (5+)- или (б-)-заряд на атоме углерода, связанный с контактным атомом функциональной группы, который наводит этот дробный заряд, «гасится» за счет смещения на этот атом обобщенного я-электронного облака, и максимальный (5±)-заряд оказывается на конечном атоме л-системы. Такое максимальное разделение (8+)- и (8-)-зарядов энергетически выгодно, так как позволяет электронам использовать максимальное пространство.
Своеобразно взаимное влияние атомов в реакциях отщепления (от англ, elimination - элиминирования) простых стабильных молекул, как сложения элементов функциональных групп, располагающихся у соседних атомов углерода:

Отщепление НВг (НС1, HI) по правилу, установленному А. М. Зайцевым, учеником А. М. Бутлерова, происходит противоположно правилу присоединения Марковникова, т. е. Н-атом удаляется вместе с Вг от наименее гидро- генизированного атома углерода. Аналогично отщепляется Н 2 0 от спиртов и гидроксидов четвертичных аминов. Это обусловлено тем, что связывающие а-орбитали вторичных С-Н-связей значительно менее стабильны (расположены выше по энергии), чем ст-орбитали первичных С-Н-связей. Еще менее
стабильны третичные -“С“Н -орбитали, которые отдают водород уходящему партнеру (Вг, ОН) с максимальной легкостью. Энергии С-Н-связей составляют: первичной 414, вторичной 393 и третичной 376 кДж/моль. Как видно, стабильность связывающих 4^“ н МО различается очень существенно.
Это обусловлено большей электроотрицательностью атома углерода (по Полингу 2,5), чем водорода (2,1). Третичный атом углерода расходует три свои связи на более электроотрицательных соседей, вторичный - на два, тогда как первичный С-атом затрачивает на углеродную связь минимум химического сродства и максимум на ЗН-атома.
Другим важным типом взаимного влияния атомов является смещение п- электронной плотности к более электроотрицательному атому или группе атомов. Если в цепи связанных атомов, кроме а-электронов, имеются также д-электроны, то введение в сопряженную тг-систему таких атомов более электронодонорного или же электроноакцепторного атома вызовет поляризацию л-системы. Например, 1,3-бутадиен, 2-метил-1,3-бутадиен (изопрен) и 2-хлор-1,3-бутадиен (хлоропрен):

В бутадиене существует взаимное влияние a-связанных атомов углерода вследствие наличия на них р г -электронов (л-симметрии). Как следует из изложенного выше, такое взаимное влияние ненасыщенных атомов называется л,л-сопряжением, или л-сопряжением. Введение в такую сопряженную систему а-электронодонорной СН 3 -группы поляризует л-систему и приводит к возрастанию порядков связей в сопряженной цепи, тогда как поляризация а,л-системы бутадиена при введении сильного электронного акцептора (атома С1), обладающего одновременно способностью вступать в тг-сопряжение, частично передавая свою электронную пару на орбиталь, приводит в
конечном итоге к уменьшению порядков связей в сопряженной л-системе. Отсюда следует, что -/-эффект атома хлора по отношению к диеновой сопряженной л-системе значительно больше, чем его +С-эффект (положительный эффект сопряжения). Поляризация сопряженных л-систем электронодонорными (ЭД) или электроноакцепторными (ЭА) заместителями изменяет также и ИСВ и приводит к появлению небольших дробных зарядов на атомах. Наибольший отрицательный (-СН 3) или положительный (-С1) заряд будет расположен на С 4 бутадиеновой цепи.
Из приведенных примеров можно сделать вывод о существовании в органических молекулах взаимного влияния химически связанных атомов нескольких типов. Это влияние выражается в виде различных электронных эффектов (электронных влияний, действий, смещений), действия друг на друга электрических полей близко расположенных атомов (эффект поля , ±F- эффект) и пространственных препятствий (стерических эффектов , ± ?-эффект), возникающих в химических реакциях в результате экранирования атомами реакционных центров молекул.
Принято различать индукционный эффект (±/-эффект) и эффект сопряжения (±С-эффект). Индукционные эффекты, обозначаемые знаками (+) или (-) в зависимости от а-электронодонорной или акцепторной способности, имеют яркое проявление в кислотно-основных свойствах молекул. Так, все галогеноуксусные кислоты сильнее уксусной, так как галогены поляризуют
все ст-связи по цепи Г-СН^- , вызывая понижение порядка связи
О-Н и повышение ее полярности, а следовательно, способности к отщеплению Н + . Поляризация связи О-Н, N-H, S-H называется ее протонизацией и приводит к увеличению кислотной диссоциации (росту К Л - константы кислотной диссоциации). Аналогично действуют все заместители - электронные акцепторы. Все электронные доноры, замещающие Н-атом в метильной группе уксусной кислоты, действуют противоположно, понижая К Л. Действие электроноактивных заместителей (доноров и акцепторов, т. е. функциональных
групп Ф, на основные центры (-В) молекул простого типа (В-R-Ф) противоположно действию на кислотные центры (-О-Н и др.). Аналогично действие ЭД- и ЭА-заместителей на реакции нуклеофильного замещения, когда одна электронодонорная функциональная группа (Ф") замещается другой
В этом случае расщепление связи углеводородного остатка (R) с контактным атомом функциональной группы (Ф") происходит за счет уменьшения порядка связи Ф^-R и ее поляризации в результате атаки Ф" своей электронной парой:
В качестве уходящей группы Ф" могут быть любые группы основной природы, такие, как СГ, Вг", Г, NCS", NOj, HSO; и т. д., а в качестве вступающей группы могут быть уже перечисленные (Ф"), а также такие, как NH 2 , SH", SR", RCOO", HSOj, НРО^ и им подобные, т. е. более сильные нуклеофилы.
В качестве сопутствующей группы (Ф), ковалентно связанной с углеводородным остатком R неароматической природы, могут выступать любые заместители. Обычно - это Н-атомы, СН 3 и другие алкилы, C 6 Hs- и остатки любых других аренов. Более сложные случаи замещения мало исследованы и не разработаны теоретически.
В молекулах и других молекулярных частицах (ионах, свободных радикалах), содержащих в цепи более трех я-орбиталей, возникают эффекты сопряжения. Они обусловлены, как было указано на примере замещенных бутадиена, взаимодействием двух или нескольких близких или различных по природе л-систем (СН 2 =СН-, СН=С- групп) или же я-систем (например, СН 2 =СН-, QH5- и т. п.) с химически активными атомами или группами
атомов, у которых есть орбитали: 1) p z - или d K -; 2) заполненные одним электроном или парой электронов; 3) свободные от электронов. Примерами таких
атомов или их групп могут быть -СН 2 , -СН 2 , -СН 2 , - СН-, -СН, ?
СН -, многочисленные гетероатомы (неметаллов и металлов) и их группировки, например, =0, -0-, “ОН, -NH 2 , -NH-, -N=, -SH, -S- и др.
Примеры пк- и л-сопряженных систем уже приводились. Из ряда наиболее распространенных и важных назовем такие, как:

В аллил-радикале в результате сопряжения трех л-электронов спиновая плотность, создаваемая неспаренным электроном, распределяется по всем трем атомам углерода, преобладая на крайних атомах (-0,622) и составляя +0,231 на среднем атоме углерода. Эти цифры, отражающие настоящее, далеко не совершенное состояние теории квантово-химических расчетов сложных молекул, показывают, что абсолютные значения величин расчет дать не может. Приведенные цифры сами по себе бессмысленны, если даже не абсурдны, так как естественно, что спиновая плотность, создаваемая в сопряженной системе единичным неспаренным электроном не должна прерываться ни на одном атоме и в сумме должна равняться единице. Из приведенных цифр следует, что электрон расщепляется на две части, которые не взаимодействуют, так как на среднем атоме углерода электронной плотности от неспаренного электрона нет. Но, несмотря на несовершенство современного расчетного аппарата сложных молекул, приведенные цифры показывают, что сумма спиновых плотностей (2-0,622) - 0,231 близка к 1 и что электрону энергетически выгоднее занимать максимальное пространство с максимальным распределением электронной спиновой плотности на крайних атомах сопряженной системы.
Еще труднее осмыслить результаты расчета распределения спиновой плотности в бензильном радикале

Из приведенной схемы видно, что дефицит электронной плотности при расчете достиг 0,2 ед. заряда электрона.
Радикал за счет этого значительно стабилизируется. В бензил-катионе вакантная р.-орбиталь взаимодействует с ВЗМО, т. е. Ч*, - орбиталью с перекачкой а- и я-электронной плотности из бензольного ядра, особенно из орто - и лдря-положений. При этом 5" + 38 = 1. В результате такого взаимного влияния а-, я-орбиталей реакционная способность бензольного ядра с электрофильными реагентами уменьшается сильнейшим образом, а с нуклеофильными, наоборот, сильно возрастает. Делокализация (+)-заряда р г
орбитали заметно стабилизирует карбкатион С 6 Н 5 СН 2 .
В трифенилметил-анионе (С 6 Н 5) 3 С‘, имеющем плоское строение и яркую (вишнево-красную) окраску в результате ля-сопряжения заполненной р г - орбитали метильного атома углерода с НВМО (т. е. Ч** э) бензольных ядер,
отрицательный заряд делокализуется по орто - и лярд-положениям бензольных ядер. За счет этого взаимного влияния атомов карбанион сильно стабилизируется, а бензольные ядра приобретают способность очень легко взаимодействовать даже со слабыми электронными акцепторами (1 2 , пиридин, C 6 H 5 N0 2 и др.).
Винилхлорид является примером mt-сопряжения между несвязывающей орбиталью (р С| , несущей пару р.-электронов, и 71- связью. В результате связь С- С 1 становится заметно прочнее (на 12 кДж/моль) и чуть короче. Атом галогена становится малореакционноспособным в реакциях замещения со щелочью. Ниже приведена энергетическая диаграмма связывающих МО винилхлорида (рис.2.21). Энергетический выигрыш mt-сопряжения возникает в

Рис. 2.21. Связывающие МО винилхлорида (лл-сопряжение)
результате возрастания так называемой области пребывания mt-электронов за счет их делокализации. Для л-электронов СН 2 =СН- слабым резервуаром делокализации может быть З^-орбиталь хлора. Аналогичная винилхлориду ситуация mt-сопряжения возникает в молекуле хлорбензола QHs-Cl, анилина СбН5-НН 2 , фенола QHs-OH:
где X - гетероатом.
Серьезного внимания заслуживает третий тип взаимного влияния атомов в молекулах, который получил название эффекта поля (^-эффект). Концепция эффекта поля разработана слабее, чем /- и С- эффектов.
В настоящее время под эффектом поля понимается воздействие статического электрического заряда ионизированных атомов, входящих в состав молекулы, или больших дробных зарядов диполей поляризованных ад- связей на соседние или близлежащие атомы той же самой молекулярной частицы.
Примером могут быть молекулы с семиполярной связью, например + +
СН 3 - S- СН 3 (диметилсульфоксид), (C 2 H 5) 3 N-О (оксид триэтиламина),
молекулы с полным разделением зарядов за счет сильных внутримолекуляр-
ных кислотно-основных взаимодействий, как, например, NH-СН 2 - СОО (глицин) и все другие аминокислоты и комплексоны, сильно полярные моле n -l/2
Кулы, например, C 6 H-_ 1/2 (нитробензол) или ионы (C 2 H 5) 4 N (тетраэтил-
аммоний), C 2 H 5 -N=N (бензолдиазоний), (С 2 Н 5) 2 ОН (диэтилгидроксоний),
ионы комплексных соединений - катионов и анионов, в числе которых можно назвать [Со(ЫН 2 СН 3) 6 ] 3+ (гексаметиламинат кобальта), *~ (феррициа-

нид), Fe(C 5 H 5) 2 (феррициний-катион), (диметилглиоксимин никеля).
Число известных соединений подобной структуры бесконечно велико. Под влиянием электрического поля точечных носителей заряда соседние химические связи поляризуются, в результате чего изменяются химические свойства связанных атомов и атомных групп, находящихся в непосредственной близости от источника заряда. При этом F-эффект обладает значительно большим дальнодействием, чем ковалентный /-эффект. Влияние электрического заряда распространяется на расстояние до 3 нм.
В целом ряде сложных молекул, содержащих в сопряженной системе функциональные группы, склонные к ионизации (кислотно-основной диссоциации) в растворах полярных растворителей, способных к донорноакцепторным взаимодействиям, заряд делокализуется по всей молекуле или отдельным ее частям.
Примером простой частицы подобного рода может быть диметилглиок- симин-анион

В этих случаях возникает эффект поля, однако механизм его действия сложен и здесь не рассматривается.
Взаимное влияние аналогичным образом проявляется как в органических, так и в неорганических комплексных соединениях. В последних взаимное влияние атомных и молекулярных орбиталей валентной оболочки получило название электронных эффектов координации. Эти эффекты обусловлены воздействием на координированные лиганды таких видов координации онной химической связи, как о-связь, дативная к-связь, обратная дативная п-связь , а также действием поля катиона. Они получили в отечественной литературе название с-эффекта координации , %-эффекта координации , обратного п-эффекта координации и эффекта заряда.
В результате действия этих эффектов при образовании комплексного соединения (М + L ML) из иона металла (М - заряд опущен) и лиганда (L - заряд опущен) свойства лигандов L в координированном состоянии могут сильно отличаться от свободных L:
Этот факт широко используется в катализе промышленных и лабораторных реакций. В этих случаях за счет введения солей ^-металлов в сферу реакции образуются комплексные соединения и такой катализ получил название «комплексного катализа».
ЛЕКЦИЯ 2
2.1. Взаимное влияние атомов в молекулах биоорганических соединений
2.1.1. Электронные эффекты заместителей. Индуктивный и мезомерный эффект. Донорные и акцепторные группы-заместители.
2.1.2. Распределение электронной плотности в биоорганических молекулах.
2.2. Кислотно-основные свойства органических соединений.
2.2.1. Теория Бренстеда-Лоури. Определения « кислоты и основания» в соответствии с теорией Бренстеда-Лоури.
2.2.2. Биоорганические соединения- кислоты. Влияние типа кислотного центра и
заместителей кислотные свойства.
2.2.3. Биоорганические соединения- основания. . Влияние типа основного центра и
заместителей основные свойства. свойства
2.3.Медико- биологическое значение изучения темы « Кислотно-основные свойства биоорганических соединений»
Исходный уровень знаний для усвоения темы
Гибридизация орбиталей и пространственная ориентация орбиталей элементов 2 периода., виды химических связей, особенности образования ковалентных σ- и π –связей, полярные и неполярные ковалентные связи, изменение электроотрицательности элементов в периоде и группе, функциональные группы, сопряженные системы, делокализация.
2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
Электронные эффекты заместителей
Ключевые слова к разделу 2.1.
Заместитель донорный, акцепторный, электроотрицательность, распределение электронной плотности в молекуле биоорганического соединения, эффект индуктивный, мезомерный
Смещение электронной плотности в биоорганических соединениях связано с различной электроотрицательностью атомов. Электронная плотность смещается всегда в сторону более электроотрицательного атома.
Ряд электроотрицательности :
F > O > N > C1 > Br > I ~ S > C > H
Функциональные группы, смещающие электронную плотность в свою сторону, являются акцепторами, а группы, «отталкивающие» от себя электронную плотность- донорами.
Для демонстрации этих явлений составляют диаграммы распределения электронной плотности , которые помогают понять направление органической реакции и объяснить, почему они именно так протекают, а не иначе. На основании распределения электронной плотности можно высказать предположение о механизме реакции и строении образующихся веществ.
Смещение электронной плотности вдоль σ –связей носит название индуктивного эффекта Атомы или функциональные группы, «отталкивающие» от себя электронную плотность, проявляют положительный (+I) а смещающие в свою сторону – отрицательный (- I) эффекты.
Индуктивный эффект обозначают стрелкой вдоль связи, которая направлена от атома с частичным положительным зарядом (б +) в сторону того атома, на котором возникает избыточный отрицательный заряд (частичный заряд б-)
Индуктивный эффект распространяется на соседние 2-3 атома по отношению к группе, вызывающей этот эффект, и по мере удаления от группы убывает.
Распределение электронной плотности в молекуле бутановой кислоты.
СН 3 -> СН 2 -> СН 2 ->СН 2 ->СООН
<------ заряд б + убывает по направлению стрелки
Смещение электронной плотности в системе сопряженных связей носит название мезомерного эффекта (М-эффект). Мезомерный эффект охватывает всюациклическую сопряженную систему, частичные заряды возникают на крайних атомах в сопряженной системе, а в бензольном кольце – изменение электронной плотности происходит в положениях 2,4,6 (по отношению к группе, проявляющей эффект).
Атомы галогенов, гидрокси- и аминогруппы содержат неподеленные пары электронов, которые смещаются в сторону π -связи, образуя общую сопряженную систему. Они проявляют +М-эффект. Карбоксильная, карбонильная, нитро-группы обладают –М-эффектом, и они смещают π-электронную плотность в свою сторону.
Примеры: пропеновая (акриловая) кислота
СН2 == СН- С ==О
Хлорвинил (хлорэтен)
С1 -СН ==СН2
Если в ароматической системе бензола присутствует заместитель – донор , то возникает частичный(избыточный) заряд δ- в положениях 2,4,6 Донорными группами. Проявляющими положительный мезомерный эффект, следует считать гидрокси, амино группы, атомы галогенов фтора и хлора.
– если заместитель – акцептор , то частичный заряд δ+ в положениях 2,4,6
Акцепторные группы: карбоксильная, альдегидная., нитро, циано.
Донор проявляет положительные + I и + М –эффекты, а акцептор - отрицательные - I и – М –эффекты.
В сопряженной системе главным считается мезомерный М-эффект.
Атом азота в шестичленных ароматических гетероциклических соединениях пиридине и пиримидине имеет отрицательный мезомерный эффект, поэтому снижается общая электронная плотность в ароматической системе(вспомните понятие π-недостаточные циклы) и по отношению к атому азота в положениях 2, 4, 6 цикла возникает недостаток электронной плотности и появляется частичный заряд б + . В никотиновой кислоте введение карбоксильной группы в молекулу пиридина увеличивает недостаток электронной плотности. Атом азота и карбоксильная группа действуют « согласованно» и создают недостаток электронной плотности в одних и тех же положениях 2,4,6 по отношению к ним.
Химические свойства органических соединений обусловлены типом химических связей, природой связываемых атомов и их вза - имным влиянием в молекуле. Эти факторы, в свою очередь, определяются электронным строением атомов и взаимодействием их атомных орбиталей.
1. Электронное строение атома углерода
Часть атомного пространства, в котором вероятность нахождения электрона максимальна, называют атомной орбиталью (АО).
В химии широко используется представление о гибридных орбиталях атома углерода и других элементов. Понятие о гибридизации как способе описания перестройки орбиталей необходимо тогда, когда число неспаренных электронов в основном состоянии атома меньше числа образуемых связей. Примером служит атом углерода, который во всех соединениях проявляет себя как четырехвалентный элемент, но в соответствии с правилами заполнения орбиталей на его внешнем электронном уровне в основном состоянии 1s22s22p2 находятся только два неспаренных электрона (рис. 2.1, а и Приложение 2-1). В этих случаях постулируется, что различные атомные орбитали, близкие по энергии, могут смешиваться между собой, образуя одинаковые по форме и энергии гибридные орбитали.
Гибридные орбитали из-за большего перекрывания образуют более прочные связи по сравнению с негибридизованными орбиталями.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном из трех состояний
Тип гибридизации определяет направленность гибридных АО в пространстве и, следовательно, геометрию молекул, т. е. их пространственное строение.
Пространственное строение молекул - это взаимное расположение атомов и атомных групп в пространстве.
sp3-Гибридизация. При смешении четырех внешних АО возбужденного атома углерода (см. рис. 2.1, б) - одной 2s - и трех 2p-орбиталей - возникают четыре равноценные sp3-гибридные орбитали. Они имеют форму объемной «восьмерки», одна из лопастей которой значительно больше другой.
Каждая гибридная орбиталь заполняется одним электроном. Атом углерода в состоянии sp3-гибридизации имеет электронную конфигурацию 1s22(sp3)4 (см. рис. 2.1, в). Такое состояние гибридизации характерно для атомов углерода в насыщенных углеводородах (алканах) и соответственно в алкильных радикалах.
Вследствие взаимного отталкивания sp3-гибридные АО направлены в пространстве к вершинам тетраэдра, и углы между ними равны 109,5? (наиболее выгодное расположение; рис. 2.2, а).
Пространственное строение изображается с помощью стереохимических формул. В этих формулах sp3-гибридизованный атом углерода и две его связи располагают в плоскости чертежа и графически обозначают обычной чертой. Жирной чертой или жирным клином обозначают связь, выходящую вперед из плоскости чертежа и направленную к наблюдателю; пунктирной линией или заштрихованным клином (..........) - связь, уходящую от наблюдателя за плоскость черте-
Рис. 2.2. Виды гибридизации атома углерода. Точка в центре - ядро атома (малые доли гибридных орбиталей для упрощения рисунка опущены; цветом показаны негибридизованные р-АО)
sp2-Гибридизация. При смешении одной 2s - и двух 2р-АО возбужденного атома углерода образуются три равноценныеsp2-гибридные орбитали и остается негибридизованной 2р-АО. Атом углерода в состоянии sp2-гибридизации имеет электронную конфигурацию 1s22(sp2)32p1 (см. рис. 2.1, г). Такое состояние гибридизации атома углерода характерно для ненасыщенных углеводородов (алкенов), а также для некоторых функциональных групп, например карбонильной и карбоксильной.
sp2-Гибридные орбитали располагаются в одной плоскости под углом 120?, а негибридизованная АО находится в перпендикулярной плоскости (см. рис. 2.2, б). Атом углерода в состоянииsp2-гибридизации имеет тригональную конфигурацию. Атомы углерода, связанные двойной связью, находятся в плоскости чертежа, а их одинарные связи, направленные к наблюдателю и от него, обозначают, как описано выше (см. рис. 2.3, б).
sp-Гибридизация. При смешении одной 2s - и одной 2р-орбиталей возбужденного атома углерода образуются две равноценные sp-гиб - ридные АО, а две p-АО остаются негибридизованными. Атом углерода в состоянии sp-гибридизации имеет электронную конфигурацию

Рис. 2.3. Стереохимические формулы метана (а), этана (б) и ацетилена (в)
1s22(sp2)22p2 (см. рис. 2.1, д). Такое состояние гибридизации атома углерода встречается в соединениях, имеющих тройную связь, например, в алкинах, нитрилах.
sp-Гибридные орбитали располагаются под углом 180?, а две негибридизованные АО - во взаимно перпендикулярных плоскостях (см. рис. 2.2, в). Атом углерода в состоянии sp-гибридизации имеет линейную конфигурацию, например в молекуле ацетилена все четыре атома находятся на одной прямой (см. рис. 2.3, в).
В гибридизованном состоянии могут находиться и атомы других элементов-органогенов.
2.2. Химические связи атома углерода
Химические связи в органических соединениях представлены в основном ковалентными связями.
Ковалентной называют химическую связь, образованную в результате обобществления электронов связываемых атомов.
Эти обобществленные электроны занимают молекулярные орбитали (МО). Как правило, МО является многоцентровой орбиталью и заполняющие ее электроны делокализованы (рассредоточены). Таким образом, МО, как и АО, может быть вакантной, заполненной одним электроном или двумя электронами с противоположными спинами*.
2.2.1. у - и р-Связи
Существуют два типа ковалентной связи: у (сигма)- и р (пи)-связи.
у-Связью называют ковалентную связь, образованную при перекрывании АО по прямой (оси), соединяющей ядра двух связывае - мых атомов с максимумом перекрывания на этой прямой.
у-Связь возникает при перекрывании любых АО, в том числе и гибридных. На рисунке 2.4 показано образование у-связи между атомами углерода в результате осевого перекрывания их гибридных sp3-АО и у-связей C-H путем перекрывания гибридной sp3-АО углерода и s-АО водорода .
* Подробнее см.: , Пузаков химия. - М.: ГЭОТАР-Медиа, 2007. - Глава 1.

Рис. 2.4. Образование у-связей в этане путем осевого перекрывания АО (малые доли гибридных орбиталей опущены, цветом показаны sp3-АО углерода, черным - s-АО водорода)
Кроме осевого возможен еще один вид перекрывания - боковое перекрывание p-АО, приводящее к образованию р-связи (рис. 2.5).
р-атомные орбитали

Рис. 2.5. Образование р-связи в этилене путем бокового перекрывания р-АО
р-Связью называют связь, образованную при боковом перекрывании негибридизованных p-АО с максимумом перекрывания по обе стороны от прямой, соединяющей ядра атомов.
Встречающиеся в органических соединениях кратные связи являются сочетанием у - и р-связей: двойная - одной у - и одной р-, тройная - одной у - и двух р-связей.
Свойства ковалентной связи выражаются через такие характеристики, как энергия, длина, полярность и поляризуемость.
Энергия связи - это энергия, выделяющаяся при образовании связи или необходимая для разъединения двух связанных атомов. Она служит мерой прочности связи: чем больше энергия, тем прочнее связь (табл. 2.1).
Длина связи - это расстояние между центрами связанных атомов. Двойная связь короче одинарной, а тройная короче двойной (см. табл. 2.1). Связи между атомами углерода, находящихся в разном состоянии гибридизации, имеют общую закономерность -
Таблица 2.1. Основные характеристики ковалентных связей

с увеличением доли s-орбитали в гибридной орбитали уменьшается длина связи. Например, в ряду соединений пропан CH3CH2CH3, пропен CH3CH=CH2, пропин CH3C=CH длина связи CH3-C соответственно равна 0,154; 0,150 и 0,146 нм.
Полярность связи обусловлена неравномерным распределением (поляризацией) электронной плотности. Полярность молекулы количественно оценивают величиной ее дипольного момента. Из дипольных моментов молекулы можно вычислить дипольные моменты отдельных связей (см. табл. 2.1). Чем больше дипольный момент, тем полярнее связь. Причиной полярности связи служит различие в электроотрицательности связанных атомов.
Электроотрицательность характеризует способность атома в молекуле удерживать валентные электроны. С увеличением электроотрицательности атома возрастает степень смещения в его сторону электронов связи.
Основываясь на значениях энергии связей, американский химик Л. Полинг (1901-1994) предложил количественную характеристику относительной электроотрицательности атомов (шкала Полинга). В этой шкале (ряду) типичные элементы-органогены располагаются по относительной электроотрицательности (для сравнения приведены два металла) следующим образом:
Электроотрицательность не является абсолютной константой элемента. Она зависит от эффективного заряда ядра, вида гибридизации АО и влияния заместителей. Например, электроотрицательность атома углерода, находящегося в состоянии sp2- или sp-гибридизации, выше, чем в состоянии sp3-гибридизации, что связано с увеличением доли s-орбитали в гибридной орбитали. При переходе атомов из sp3- в sp2- и далее в sp-гибридизованное состояние постепенно уменьшается протяженность гибридной орбитали (особенно в направлении, обеспечивающем наибольшее перекрывание при образовании у-связи), а это означает, что в такой же последовательности максимум электронной плотности располагается все ближе к ядру соответствующего атома.
В случае неполярной или практически неполярной ковалентной связи разность в электроотрицательности связанных атомов равна нулю или близка к нулю. С увеличением разности в электроотрицательности возрастает полярность связи. При разности до 0,4 говорят о слабо полярной, более 0,5 - о сильно полярной ковалентной связи и более 2,0 - об ионной связи. Полярные ковалентные связи предрасположены к гетеролитическому разрыву
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер атомов. По поляризуемости р-связь значительно превосходит у-связь, так как максимум электронной плотности р-связи располагается дальше от связываемых ядер. Поляризуемость в значительной мере определяет реакционную способность молекул по отношению к полярным реагентам.
2.2.2. Донорно-акцепторные связи
Перекрывание двух одноэлектронных АО - не единственный путь образования ковалентной связи. Ковалентная связь может образовываться при взаимодействии двухэлектронной орбитали одного атома (донора) с вакантной орбиталью другого атома (акцептора). Донорами служат соединения, содержащие либо орбитали с неподеленной парой электронов, либо р-МО. Носителями неподеленных пар электронов (n-электронов, от англ. non-bonding) являются атомы азота , кислорода, галогенов.
Неподеленные пары электронов играют важную роль в проявлении химических свойств соединений. В частности, они ответственны за способность соединений вступать в донорно-акцепторное взаимо - действие.
Ковалентая связь, образующаяся за счет пары электронов одного из партнеров по связи, называется донорно-акцепторной.

Образовавшаяся донорно-акцепторная связь отличается только способом образования; по свойствам она одинакова с остальными ковалентными связями. Атом-донор при этом приобретает положительный заряд.
Донорно-акцепторные связи характерны для комплексных соединений.
2.2.3. Водородные связи
Атом водорода, связанный с сильно электроотрицательным элементом (азотом, кислородом, фтором и др.), способен взаимодействовать с неподеленной парой электронов другого достаточно электроотрицательного атома этой же или другой молекулы. В результате возникает водородная связь, являющаяся разновидностью донорно-
акцепторной связи. Графически водородную связь обычно обозначают тремя точками.
Энергия водородной связи невелика (10-40 кДж/моль) и в основном определяется электростатическим взаимодействием.
Межмолекулярные водородные связи обусловливают ассоциацию органических соединений, например спиртов.

Водородные связи влияют на физические (температуры кипения и плавления, вязкость, спектральные характеристики) и химические (кислотно-основные) свойства соединений. Так, температура кипения этанола C2H5OH (78,3 ?С) значительно выше, чем имеющего одинаковую с ним молекулярную массу диметилового эфира CH3OCH3 (-24 ?C), не ассоциированного за счет водородных связей.
Водородные связи могут быть и внутримолекулярными. Такая связь в анионе салициловой кислоты приводит к повышению ее кислотности.
Водородные связи играют важную роль в формировании пространственной структуры высокомолекулярных соединений - бел - ков, полисахаридов, нуклеиновых кислот.
2.3. Сопряженные системы
Ковалентная связь может быть локализованной и делокализованной. Локализованной называют связь, электроны которой фактически поделены между двумя ядрами связываемых атомов. Если электроны связи поделены более чем между двумя ядрами, то говорят о делокализованной связи.
Делокализованная связь - это ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов.
Делокализованные связи в большинстве случаев являются р-связями. Они характерны для сопряженных систем. В этих систе - мах осуществляется особый вид взаимного влияния атомов - сопряжение.
Сопряжение (мезомерия, от греч. mesos - средний) - это выравнивание связей и зарядов в реальной молекуле (частице) по сравнению с идеальной, но не существующей структурой.
Участвующие в сопряжении делокализованные р-орбитали могут принадлежать либо двум р-связям и более, либо р-связи и одному атому с р-орбиталью. В соответствии с этим различают р, р-сопряжение и с, р-сопряжение. Система сопряжения может быть открытой или замкнутой и содержать не только атомы углерода, но и гетероатомы.
2.3.1. Системы с открытой цепью сопряжения
р, р-Сопряжение. Простейшим представителем р, р-сопряженных систем с углеродной цепью служит бутадиен-1,3 (рис. 2.6, а). Атомы углерода и водорода и, следовательно, все у-связи в его молекуле лежат в одной плоскости, образуя плоский у-скелет. Атомы углерода находятся в состоянии sр2-гибридизации. Негибридизованные р-АО каждого атома углерода расположены перпендикулярно плоскости у-скелета и параллельно друг другу, что является необходимым условием для их перекрывания. Перекрывание происходит не только между р-АО атомов С-1 и С-2, С-3 и С-4, но и между р-АО атомов С-2 и С-3, в результате чего образуется охватывающая четыре атома углерода единая р-система, т. е. возникает делокализованная ковалентная связь (см. рис. 2.6, б).

Рис. 2.6. Атомно-орбитальная модель молекулы бутадиена-1,3
Это отражается в изменении длин связей в молекуле. Длина связи С-1-С-2, а также С-3-С-4 в бутадиене-1,3 несколько увеличена, а расстояние между С-2 и С-3 укорочено по сравнению с обычными двойными и одинарными связями. Другими словами, процесс делокализации электронов приводит к выравниванию длин связей.
Углеводороды с большим числом сопряженных двойных связей распространены в растительном мире. К ним относятся, например, каротины, обусловливающие окраску моркови, томатов и т. п.
Открытая система сопряжения может включать и гетероатомы. Примером открытых р, р-сопряженных систем с гетероатомом в цепи могут служить б, в-ненасыщенные карбонильные соединения. Например, альдегидная группа в акролеине CH2=CH-CH=O явля - ется участником цепи сопряжения трех sр2-гибридизованных атомов углерода и атома кислорода. Каждый из этих атомов вносит в единую р-систему по одному р-электрону.
pn-Сопряжение. Этот вид сопряжения чаще всего проявляется в соединениях, содержащих структурный фрагмент - CH=CH-X, где X - гетероатом, имеющий неподеленную пару электронов (прежде всего O или N). К ним относятся, например, виниловые эфиры, в молекулах которых осуществляется сопряжение двойной связи с р-орбиталью атома кислорода. Делокализованная трехцен - тровая связь образуется путем перекрывания двух р-АО sр2-гиб - ридизованных атомов углерода и одной р-АО гетероатома с парой и-электронов.

Образование аналогичной делокализованной трехцентровой связи имеется в карбоксильной группе. Здесь в сопряжении участвуют р-электроны связи С=О и n-электроны атома кислорода группы ОН. К сопряженным системам с полностью выровненными связями и зарядами относятся отрицательно заряженные частицы, например ацетат-ион.

Направление смещения электронной плотности обозначается изогнутой стрелкой.
Существуют и другие графические способы отображения результатов сопряжения. Так, структура ацетат-иона (I) предполагает, что заряд равномерно распределен по обоим атомам кислорода (как показано на рис. 2.7, что соответствует действительности).
Структуры (II) и (III) применяются в теории резонанса. Согласно этой теории реальная молекула или частица описывается набором определенных так называемых резонансных структур, которые отличаются друг от друга только распределением электронов. В сопряженных системах основной вклад в резонансный гибрид вносят структуры с различным распределением р-электронной плотности (двусторонняя стрелка, связывающая эти структуры, является специальным символом теории резонанса).
Предельные (граничные) структуры в действительности не существуют. Однако они в той или иной степени «вносят вклад» в реальное распределение электронной плотности в молекуле (частице), которую представляют в виде резонансного гибрида, получающегося путем наложения (суперпозиции) предельных структур.
В с, р-сопряженных системах с уг - леродной цепью сопряжение может осуществляться при наличии рядом с р-связью атома углерода с негибридизованной р-орбиталью. Такими системами могут быть промежуточные частицы - карбанионы, карбокатионы, свободные радикалы, например, аллильной структуры. Свободнорадикальные аллильные фрагменты играют важную роль в процессах пероксидого окисления липидов.
В аллил-анионе CH2=CH-CH2 sр2-гибридизованный атом углерода С-3 поставляет в общую сопряженную

Рис. 2.7. Карта электронной плотности группы COONa в пе - нициллине
систему два электрона, в аллильном радикале CH2=CH-CH2+ - один, а в аллильном карбокатионе CH2 =CH-CH2+ не поставляет ни одного. В результате при перекрывании p-АО трех sp2-гибридизованных атомов углерода образуется делокализованная трехцентровая связь, содержащая четыре (в карбанионе), три (в свободном радикале) и два (в карбокатионе) электрона соответственно.

Формально атом С-3 в аллил-катионе несет положительный заряд, в аллильном радикале - неспаренный электрон, а в аллил-анионе - отрицательный заряд. В действительности в таких сопряженных системах имеется делокализация (рассредоточение) электронной плотности, что приводит к выравниванию связей и зарядов. Атомы С-1 и С-3 в этих системах равноценны. Например, в аллил-катионе каждый из них несет положительный заряд +1/2 и связан «полуторной» связью с атомом С-2.
Таким образом, сопряжение приводит к существенному различию в распределении электронной плотности в реальных структурах по сравнению со структурами, изображаемыми обычными формулами строения.
2.3.2. Системы с замкнутой цепью сопряжения
Циклические сопряженные системы представляют большой интерес как группа соединений с повышенной термодинамической устой - чивостью по сравнению с сопряженными открытыми системами. Эти соединения обладают и другими особыми свойствами, совокупность которых объединяют общим понятием ароматичность. К ним относятся способность таких формально ненасыщенных соединений
вступать в реакции замещения, а не присоединения, устойчивость к действию окислителей и температуры.
Типичными представителями ароматических систем являются арены и их производные. Особенности электронного строения арома - тических углеводородов наглядно проявляются в атомно-орбитальной модели молекулы бензола. Каркас бензола образуют шесть sp2-гибри - дизованных атомов углерода. Все у-связи (C-C и C-H) лежат в одной плоскости. Шесть негибридизованных р-АО расположены перпендикулярно плоскости молекулы и параллельно друг другу (рис. 2.8, а). Каждая р-АО в равной степени может перекрываться с двумя соседними р-АО. В результате такого перекрывания возникает единая делокализованная р-система, наибольшая электронная плотность в которой находится над и под плоскостью у-скелета и охватывает все атомы углерода цикла (см. рис. 2.8, б). р-Электронная плотность равномерно распределена по всей циклической системе, что обозначается кружком или пунктиром внутри цикла (см. рис. 2.8, в). Все связи между атомами углерода в бензольном кольце имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей.
На основании квантовомеханических расчетов установлено, что для образования таких стабильных молекул плоская циклическая система должна содержать (4n + 2) р-электронов, где n = 1, 2, 3 и т. д. (правило Хюккеля, 1931). С учетом этих данных можно конкретизировать понятие «ароматичность».
Соединение ароматично, если оно имеет плоский цикл и сопряженную р-электронную систему, охватывающую все атомы цикла и содержащую (4n + 2) р-электронов.
Правило Хюккеля применимо к любым плоским конденсированным системам, в которых нет атомов, являющихся общими более чем для

Рис. 2.8. Атомно-орбитальная модель молекулы бензола (атомы водорода опущены; объяснение в тексте)
двух циклов. Такие соединения с конденсированными бензольными ядрами, как нафталин и другие, отвечают критериям ароматичности.

Устойчивость сопряженных систем. Образование сопряженной и особенно ароматической системы - энергетически выгодный процесс, так как при этом увеличивается степень перекрывания орбиталей и происходит делокализация (рассредоточение) р-электронов. В связи с этим сопряженные и ароматические системы обладают повышенной термодинамической устойчивостью. Они содержат меньший запас внутренней энергии и в основном состоянии занимают более низкий энергетический уровень по сравнению с несопряженными системами. По разнице этих уровней можно количественно оценить термодинамическую устойчивость сопряженного соединения, т. е. его энергию сопряжения(энергию делокализации). Для бутадиена-1,3 она невелика и составляет около 15 кДж/моль. С увеличением длины сопряженной цепи энергия сопряжения и соответственно термодинамическая устойчивость соединений возрастают. Энергия сопряжения для бензола гораздо больше и составляет 150 кДж/моль.
2.4. Электронные эффекты заместителей 2.4.1. Индуктивный эффект
Полярная у-связь в молекуле вызывает поляризацию ближайших у-связей и ведет к возникновению частичных зарядов на соседних атомах*.
Заместители вызывают поляризацию не только «своей», но и соседних у-связей. Этот вид передачи влияния атомов называют индуктивным эффектом (/-эффект).
Индуктивный эффект - передача электронного влияния заместителей в результате смещения электронов у-связей.
Из-за слабой поляризуемости у-связи индуктивный эффект затухает через три-четыре связи в цепи. Его действие наиболее сильно проявляется по отношению к атому углерода, соседнему с тем, у которого находится заместитель. Направление индуктивного эффекта заместителя качественно оценивается путем его сравнения с атомом водорода, индуктивный эффект которого принят за нуль. Графически результат /-эффекта изображают стрелкой, совпадающей с положением валентной черточки и направленной острием в сторону более электроотрицательного атома.
/в\сильнее, чем атом водорода, проявляет отрицательный индуктив - ный эффект (-/-эффект).
Такие заместители в целом понижают электронную плотность системы, их называют электроноакцепторными. К ним относится большинство функциональных групп: OH, NH2, COOH, NO2 и катионных групп, например - NH3+.
Заместитель, смещающий по сравнению с атомом водорода электронную плотность у-связи в сторону атома углерода цепи, проявляет положительный индуктивный эффект (+/-эффект).
Такие заместители повышают электронную плотность в цепи (или кольце) и называются электронодонорными. К их числу относятся алкильные группы, находящиеся у sр2-гибридизованного атома углерода, и анионные центры в заряженных частицах, например - О-.
2.4.2. Мезомерный эффект
В сопряженных системах в передаче электронного влияния основную роль играют р-электроны делокализованных ковалентных связей. Эффект, проявляющийся в смещении электронной плотности делокализованной (сопряженной) р-системы, называют мезомерным (M-эффект), или эффектом сопряжения.
Мезомерный эффект - передача электронного влияния заместителей по сопряженной системе.
При этом заместитель сам является участником сопряженной системы. Он может вносить в систему сопряжения либо р-связь (карбонильная, карбоксильная группы и др.), либо неподеленную пару электронов гетероатома (амино - и гидроксигруппы), либо вакантную или заполненную одним электроном р-АО.
Заместитель, повышающий электронную плотность в сопряженной системе, проявляет положительный мезомерный эффект (+М - эффект).
М-Эффектом обладают заместители, включаю - щие атомы с неподеленной парой электронов (например, аминогруппа в молекуле анилина) или целым отрицательным зарядом. Эти заместители способны
к передаче пары электронов в общую сопряженную систему, т. е. являются электронодонорными.
Заместитель, понижающий электронную плотность в сопряженной системе, проявляет отрицательный мезомерный эффект (-М - эффект).
М-Эффектом в сопряженной системе обладают атомы кислорода или азота, связанные двойной связью с атомом углерода, как показано на примере акриловой кислоты и бензальдегида. Такие группировки являютсяэлектроноакцепторными.


Смещение электронной плотности обозначается изогнутой стрелкой, начало которой показывает, какие р - или р-электроны смещаются, а конец - связь или атом, к которым они смещаются. Мезомерный эффект, в отличие от индуктивного, передается по системе сопряженных связей на значительно большее расстояние.
При оценке влияния заместителей на распределение электронной плотности в молекуле необходимо учитывать результирующее действие индуктивного и мезомерного эффектов (табл. 2.2).
Таблица 2.2. Электронные эффекты некоторых заместителей

Электронные эффекты заместителей позволяют дать качественную оценку распределения электронной плотности в нереагирующей молекуле и прогнозировать ее свойства.
Лекция 3
Тема: Взаимное влияние атомов в молекулах органических соединений
Цель: изучение электронного строения органических соединений и способов передачи взаимного влияния атомов в их молекулах.
План:
1. Индуктивный эффект
2. Виды сопряжения.
3. Ароматичность органических соединений
4. Мезомерный эффект (эффект сопряжения)
Индуктивный эффект
Молекула органического соединения представляет собой совокупность атомов, связанных в определённом порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности (Э.О.).
· Электроотрицательность – способность атома притягивать электронную плотность другого атома для осуществления химической связи.
Чем больше величина Э.О. данного элемента, тем сильнее он притягивает электроны связи. Величины Э.О. были установлены американским химиком Л. Полингом и этот ряд называется шкалой Полинга.
Э. О. атома углерода зависит от состояния его гибридизации, т.к. атомы углерода, находящиеся в различных видах гибридизации отличаются друг от друга по Э. О. и это зависит от доли s-облака в данном виде гибридизации. Например, атом С в состоянии sp 3 -гибридизации обладает наименьшей Э.О. так как на долю р-облака приходится меньше всего s-облака. Большей Э.О. обладает атом С в sp- гибридизации.
Все атомы, составляющие молекулу находятся во взаимной связи друг с другом и испытывают взаимное влияние. Это влияние передаётся по ковалентным связям с помощью электронных эффектов.
Одним из свойств ковалентной связи является некоторая подвижность электронной плотности. Она способна смещаться в сторону атома с большей Э,О.
· Полярность ковалентной связи – это неравномерное распределение электронной плотности между связанными атомами.
Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону более Э.О. атома, т. е. происходит передача электронного эффекта.
· Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается I.
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании ϭ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну две связи. Направление смещения электронной плотности всех σ-связей обозначают прямыми стрелками.→
Например: СH 3 δ + < → CH 2 δ +< → CH 2 δ +< →Cl δ - Э.О. Сl > Э.О. С
СH 3 δ +< → CH 2 δ +< → CH 2 δ +< →OH δ - Э.О. ОН > Э.О. С
· Атом или группа атомов, смещающие электронную плотность ϭ-связи от атома углерода на себя называются электроноакцепторными заместителями и проявляют отрицательный индуктивный эффект (-I-эффект).
Ими являются галогены (Cl, Br, I), OH - , NH 2 - , COOH, COH, NO 2 , SO 3 H и др.
· Атом или группа атомов, отдающие электронную плотность называются электронодонорными заместителями и проявляют положительный индуктивный эффект (+I-эффект).
I-эффектпроявляют алифатические углеводородные радикалы, СН 3 , С 2 Н 5 и др.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Например, в молекуле пропена группа СН 3 проявляет +I-эффект, так как атом углерода в ней находится в sp 3 -гибридном состоянии, а атомы углерода при двойной связи в sp 2 -гибридном состоянии и проявляют большую электроотрицательность, поэтому проявляют -I-эффект и являются электроноакцепторами.
Сопряженные системы. Виды сопряжения.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
Ранее было показано, что в молекулах, имеющих только ϭ-связи, взаимное влияние атомов в случае их различной Э,О. осуществляется через индуктивный эффект. В молекулах, представляющих собою сопряженные системы, проявляется действие другого эффекта – мезомерного, или эффекта сопряжения.
· Влияние заместителя, передающееся по сопряженной системе π-связей, называется мезомерным эффектом (М).
Прежде, чем говорить о мезомерном эффекте необходимо разобрать вопрос о сопряженных системах.
Сопряжение имеется в молекулах многих органических соединений (алкадиены, ароматические углеводороды, карбоновые кислоты, мочевина и др.).
Соединения с чередующимся расположением двойных связей, образуют сопряженные системы.
· Сопряжение – образование единого электронного облака в результате взаимодействия неги негибридизованных р z - орбиталей в молекуле с чередующимися двойными и одинарными связями.
 |
Простейшим сопряженным соединением является бутадиен-1,3. Все четыре атома углерода в молекуле бутадиена-1,3 находятся в состоянии sp 2 -
гибридизации. Все эти атомы лежат в одной плоскости и составляют σ-скелет молекулы (см. рисунок).
Негибридизованные р – орбитали каждого атома углерода расположены перпендикулярно этой плоскости и параллельно друг другу. Это создаёт условия для их взаимного перекрывания. Перекрывание этих орбиталей происходит не только между атомами С-1 и С-2 и С-3 и С-4, но и частично между атомами С-2 и С-3. При перекрывании четырёх р z -орбиталей происходит образование единого π-электронного облака, т.е. сопряжение двух двойных связей. Этот тип сопряжения называется π, π-сопряжением , т. к взаимодействуют орбитали π-связей. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация π-электронов и тем устойчивее молекула. В сопряженной системе π-электроны уже не принадлежат определённым связям, они делокализованы т. е равномерно распределены по всей молекуле. Делокализация π-электронов в сопряженной системе сопровождается выделением энергии, которая называется энергией сопряжения. Такие молекулы более устойчивы, чем системы с изолированными двойными связями. Объясняется это тем, что энергия таких молекул ниже. В результате делокализации электронов при образовании сопряженной системы происходит частичное выравнивание длин связей: одинарная становится короче, а двойная – длиннее.
Система сопряжения может включать и гетероатомы. Примером π,π-сопряженных систем с гетероатомом в цепи могут служить α и β – ненасыщенные карбонильные соединения. Например, в акролеине (пропен-2-аль) СН 2 = СН – СН = О.
Цепь сопряжения включает три sp 2 -гибридизованных атома углерода и атом кислорода, каждый из которых вносит в единую π-систему по одному р-электрону.
р,π-сопряжение. В р,π-сопряженных системах в образовании сопряжения принимает участие атомы с неподеленной донорной электронной парой. Это могут быть: Cl, O, N, S и др. К таким соединениям относятся галогениды, эфиры, ацетамиды, карбкатионы. В молекулах этих соединений осуществляется сопряжение двойной связи с р-орбиталью гетероатома. Делокализованная трехцентровая связь образуется путем перекрывания двух р-орбиталей sp 2 -гибридизованных атома углерода и одной р-орбиталью гетероатома с парой электронов.

Образование аналогичной связи можно показать в амидной группе, являющейся важным структурным фрагментом пептидов и белков. Амидная группа молекулы ацетамида включает два гетероатома азот и кислород. В р, π-сопряженииучаствуют π-электроны поляризованной двойной связи карбонильной группы и донорная электронная пара атома азота.
|
Сопряжение может возникать и в циклических системах. К ним в первую очередь относятся арены и их производные. Простейшим представителем является бензол. Все атомы углерода в молекуле бензола находятся в sp 2 -гибридизации. Шесть sp-гибридных облака образуют каркас бензола. Все ϭ-связи (С – С и С – Н) лежат в одной плоскости. Шесть негидридизованных р-орбиталей расположены перпендикулярно плоскости молекулы и параллельно друг другу. Каждая р-орбиталь в равной степени может перекрываться с двумя соседними р-орбиталями. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью ϭ-скелета и охватывает все атомы углерода цикла. π-электронная плотность равномерно распределена по всей циклической системе. Все связи между атомами углерода имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей.


Ароматичность
Это понятие, включающее различные свойства ароматических соединений ввёл немецкий физик Э. Хюккель (1931).
Условия ароматичности:
· плоский замкнутый цикл
· все атомы С находятся в sp 2 – гибридизации
· образуется единая сопряженная система всех атомов цикла
· выполняется правило Хюккеля: “В сопряжении участвуют 4n+2 p-электронов, где n = 1, 2, 3... ”
Простейший представитель ароматических углеводородов – бензол. Он удовлетворяет всем четырем условиям ароматичности.
Правило Хюккеля: 4n+2 = 6, n = 1.
Мезомерный эффект
В отличие от несопряженных в которых электронное влияние заместителей передается по σ-связям (индуктивный эффект), в сопряженных системах в передаче электронного влияния основную роль играют π-электроны делокализованных ковалентных связей. Эффект, проявляющийся в смещении электронной плотности делокализованной (сопряженной) π-системы, называют эффектом сопряжения или мезомерным эффектом.
· Мезомерный эффект (+М, -М) – передача электронного влияния заместителя по сопряженной системе.
При этом заместитель становится частью сопряженной системы. Он может вносить в систему сопряжения π-связь (карбонильная, карбоксильная, нитро группа, сульфогруппа и др.), неподелённую пару электронов гетероатома (галогены, амино-, гидроксильную группы), вакантную или заполненную одним или двумя электронами р-орбиталей. Обозначается буквой М и изогнутой стрелкой Мезомерный эффект может быть «+» или «–».
Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект. Они содержат атомы с неподеленной электронной парой или отрицательным зарядом и способны к передаче своих электронов в общую сопряженную систему, т. е. являются электронодонорами.(ЭД) . Они направляют реакции S E в положения 2,4,6 и называются ориентантами I рода
Примеры ЭД:
Заместитель, притягивающий электроны из сопряженной системы, проявляет –М и наз-ся электроноакцептором (ЭА ). Это заместители, имеющие двойную связь
Бензальдегид
Таблица 1 Электронные эффекты заместителей
| Заместители | Ориентанты в С 6 Н 5 -R | I | М |
| Аlk (R-): СН 3 -, С 2 Н 5 -... | Ориентанты I рода: направляют ЭД заместители в орто- и пара- положения | + | |
| – Н 2 , –NНR, –NR 2 | – | + | |
| – Н, – Н, – R | – | + | |
| –Н L | – | + | |