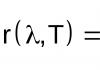Соли азотной и азотистой кислот. Азотистая кислота HNO2 Химические свойства азотистой кислоты таблица
2 HNO 2 NO + NO 2 + H 2 O .
Соли азотистой кислоты называются нитритами или азотистокислыми . Нитриты гораздо более устойчивы, чем HNO 2 , все они токсичны.
2HNO 2 + 2HI = I 2 + 2NO + 2H 2 O,
HNO 2 + H 2 O 2 = HNO 3 + H 2 O,
5KNO 2 + 2KMnO 4 + 3H 2 SO 4 = 5KNO 3 + K 2 SO 4 + 2MnSO 4 + 3H 2 O.
Строение азотистой кислоты.
В газовой фазе планарная молекула азотистой кислоты существует в виде двух конфигураций цис- и транс-:

При комнатной температуре преобладает транс-изомер: эта структура является более устойчивой. Так, для цис - HNO 2 (г) DG° f = −42,59 кДж/моль, а для транс-HNO 2 (г) DG = −44,65 кДж/моль.
Химические свойства азотистой кислоты.
В водных растворах существует равновесие:
Нагреваясь, раствор азотистой кислоты распадается с выделением NO и образованием азотной кислоты:
HNO 2 в водных растворах диссоциирует (K D =4,6·10 −4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
Азотистая кислота проявляет окислительные и восстановительные свойства. При действии более сильных окислителей (пероксид водорода , хлор , перманганат калия) происходит окисление в азотную кислоту:
Кроме того, она может окислять вещества, которые обладают восстановительными свойствами:
Получение азотистой кислоты.
Азотистую кислоту получают при растворении оксида азота (III) N 2 O 3 в воде:
Кроме того, она образуется при растворении в воде оксида азота (IV) NO 2 :
.
Применение азотистой кислоты.
Азотистая кислота применяется для диазотирования первичных ароматических аминов и образования солей диазония. Нитриты применяются в органическом синтезе в производстве органических красителей.
Физиологическое действие азотистой кислоты.
Азотистая кислота является токсичной и обладает ярко выраженным мутагенным действием, так как является деаминирующим агентом.
Азотная кислота ( HNO2) может существовать только в виде раствора или газа. Раствор обладает приятным голубым оттенком и устойчив при нуле градусов. Газовая фаза азотной кислоты изучена гораздо лучше, чем . Ее молекула имеет плоскую структуру. Валентные углы, образованные атомами равны 102ᵒ и 111ᵒ соответственно. Атом азота находится в состоянии sp2-гибридизации и имеет пару несвязанных с самой молекулой электронов. Его степень окисления в азотистой кислоте составляет +3. Длина связи атомов не превышает 0,143 нм. Такое объясняет значения температуры плавления и кипения этой кислоты, которые составляют 42 и 158 градусов соответственно.
Степень окисления азота в соединении не является высшей или низшей. Это означает, что азотистая кислота может проявлять и окислительные, и восстановительные свойства. При нагревании ее раствора образуется азотная кислота (ее химическая HNO3), диоксид азота NO, бесцветный ядовитый газ, и вода. Ее окислительные свойства проявляются в реакции с йодоводородной кислотой (образуется вода, йод и NO).
Восстановительные реакции азотистой кислоты сводятся к получению азотной кислоты. При реакции с пероксидом водорода образуется водный раствор азотной кислоты. Взаимодействие с сильной марганцевой кислотой приводит к выделению водного раствора нитрата марганца и азотной кислоты.
Азотистая кислота при попадании в организм человека вызывает мутагенные изменения, т.е. различные мутации. Она становится причиной качественного или количественного изменения хромосом.
Соли азотистой кислоты
Соли азотистой кислоты называются нитритами. Они более устойчивы к высоким температурам. Некоторые из них токсичны. При реакции с сильными кислотами они образуют сульфаты соответствующих металлов и азотистую кислоту, которая вытесняется более сильными кислотами. Многие используются в производстве некоторых красителей, а также в медицине.
Нитрит натрия используется в пищевой промышленности (добавка E250). Это гигроскопичный порошок белого или желтоватого цвета, который окисляется на воздухе до нитрата натрия. Он способен убивать бактерии и предотвращать процессы окисления. Благодаря этим свойствам, его применяют и в медицине как противоядие при отравлении людей или животных цианидами.
Если нагревать калиевую или натриевую селитру, они теряют часть своего кислорода и переходят в соли азотистой кислоты HNO 2 . Разложение идет легче в присутствии свинца, связывающего выделяющийся :
KNO 3 + Pb = KNO 2 + PbO
Соли азотистой кислоты - нитриты - кристаллические , хорошо растворимые в воде (за исключением серебряной соли). NaNO 2 широко применяется при производстве различных красителей.
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
2NaNO 2 + H 2 SO 4 = Na 2 SO 4 + 2HNO 2
Она принадлежит к числу слабых кислот (К = 5 10 -4) и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается с выделением окиси и двуокиси азота:
2HNO 2 = NO + NO 2 + H 2 O
Азотистая кислота - сильный , но в же время при действии других, более энергичных окислителей сама может окисляться в азотную кислоту.
Вы читаете, статья на тему Азотистая кислота HNO2
Азотистая кислота
HNO 2 - слабая одноосновная кислота, существует только в разбавленных водных растворах.
Соли азотистой кислоты называются нитритами. Нитриты гораздо более устойчивы, чем HNO 2 , все они токсичны.
Получение:
1. N 2 O 3 + H 2 O = 2HNO 2
Как можно еще получить азотистую кислоту? ()
Какая степень окисления в азотистой кислоте?
Значит, кислота проявляет как окислительные, так и восстановительные свойства.
При действии более сильных окислителей окисляется в HNO 3:
5HNO 2 +2HMnO 4 → 2Mn(NO 3) 2 + HNO 3 + 3H 2 O;
HNO 2 + Cl 2 + H 2 O → HNO 3 + 2HCl.
2HNO 2 + 2HI → 2NO + I 2 ↓ + 2H 2 O – восстановительные свойства
Качественная реакция на нитрит-ион NO 2 – – взаимодействие нитритов с раствором йодида калия КI, подкисленным разбавленной серной кислотой.
Как должна изменить окраску йодкрахмальная бумажка под действием свободного I 2 ?

Получение солей (нитратов и нитритов)
Назовите способы получения солей, которые вам известны? Как можно получить нитраты и нитриты?
1) Металл + неметалл = соль;
2) металл + кислота = соль + водород;
3) оксид металла + кислота = соль + вода;
4) гидроксид металла + кислота = соль + вода;
5) гидроксид металла + кислотный оксид = соль + вода;
6) оксид металла + оксид неметалла = соль;
7) соль 1 + гидроксид металла (щелочь) = соль 2 + гидроксид металла (нерастворимое основание);
8) соль 1 + кислота (сильная) = соль 2 + кислота (слабая);
9) соль 1 + соль 2 = соль 3 + соль 4
10) соль 1 + металл (активный) = соль 2 + металл (менее активный).
Специфический способ получения нитратов и нитритов:

диспропорционирование.
В присутствии избытка кислорода

Соли азотной кислоты – нитраты
нитраты щелочных металлов, кальция, аммония – селитры
KNO 3 - калийная селитра,
NH 4 NO 3 - аммиачная селитра.
Физические свойства:
Все нитраты твёрдые кристаллические вещества, белого цвета, хорошо растворимые в воде. Ядовиты!
Химические свойства нитратов
Взаимодействие нитратов с металлами, кислотами, щелочами, солями
Задание . Отметить признаки каждой реакции, записать молекулярные и ионные уравнения, соответствующие схемам:
Cu(NO 3) 2 + Zn… ,
AgNO 3 + HCl… ,
Cu(NO 3) 2 + NaOH… ,
AgNO 3 + BaCl 2 … .
Разложение нитратов
При нагревании твердых нитратов все они разлагаются с выделением кислорода (исключением является нитрат аммония), при этом их можно разделить на три группы.
Первую группу составляют нитраты щелочных металлов
2КNО 3 = 2КNО 2 + О 2 .
Вторую группу от щелочноземельных металлов до меди включительно
2Сu(NО 3) 2 = 2СuО + 4NО 2 + O 2 ,
Третью группу Ме после Сu
Hg(NО 3) 2 = Нg + 2NО 2 + О 2 ,
Почему азота в природе много (он входит в состав атмосферы), а растения часто дают плохой урожай из-за азотного голодания? (Растения не могут усваивать молекулярный азот из воздуха. При недостатке азота задерживается образование хлорофилла, задерживается рост и развитие растения.)
Назовите способы усвоения атмосферного азота.
(Часть связанного азота поступает в почву во время гроз. Бобовые, на корнях которых развиваются клубеньковые бактерии, способные связывать атмосферный азот, переводя его в соединения, доступные для растений.)
Снимая урожаи, человек ежегодно уносит вместе с ними огромные количества связанного азота. Эту убыль он покрывает внесением не только органических, но и минеральных удобрений (нитратных, аммиачных, аммонийных). Азотные удобрения вносят под все культуры. Азот усваивается растениями в виде катиона аммония и нитрат-аниона NO 3 – .
Доклады учеников
Влияние нитратов на окружающую среду и организм человека
Первая помощь при отравлении нитратами
Причины накопления нитратов в овощах и способы выращивания экологически чистой продукции растениеводства
Азотистая кислота
Если нагревать нитрат калия или натрия, то они теряют часть кислорода и переходят в соли азотистой кислоты HNO2. Разложение идет легче в присутствии свинца, связывающего выделяющийся кислород:
Соли азотистой кислоты - нитриты - образуют кристаллы, хорошо растворимые в воде (за исключением нитрита серебра). Нитрит натрия NaNO 2 применяется при производстве различных красителей.
При действии на раствор какого-нибудь нитрита разбавленной серной кислотой получается свободная азотистая кислота:
Она принадлежит к числу слабых кислот (K = A- 10~ 4) и известна только в сильно разбавленных водных растворах. При концентрировании раствора или при его нагревании азотистая кислота распадается:
Степень окисленности азота в азотистой кислоте равна +3, т.е. является промежуточной между низшими и высшей из возможных значений степени окисленности азота. Поэтому HNO 2 проявляет окислительно-восстановительную двойственность. Под действием восстановителей она восстанавливается (обычно до NO), а в реакциях с окислителями - окисляется до HNO 3 . Примерами могут служить следующие реакции:
Азотная кислота
Чистая азотная кислота HNO3 - бесцветная жидкость плотностью 1,51 г/см3, при -42 0C застывающая в прозрачную кристаллическую массу. На воздухе она, подобно концентрированной соляной кислоте, «дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана.
Азотная кислота не отличается прочностью. Уже под влиянием света она постепенно разлагается:
Чем выше температура и чем концентрированнее кислота, тем быстрее идет разложение. Выделяющийся диоксид азота растворяется в кислоте и придает ей бурую окраску.
Азотная кислота принадлежит к числу наиболее сильных кислот; в разбавленных растворах она полностью распадается на ионы H + и NO 3 .
Характерным свойством азотной кислоты является ее ярко выраженная окислительная способность. Азотная кислота - один из энергичнейших окислителей. Многие неметаллы легко окисляются ею, превращаясь в соответствующие кислоты. Так, сера при кипячении с азотной кислотой постепенно окисляется в серную кислоту, фосфор - в фосфорную. Тлеющий уголек, погруженный в концентрированную HNO 3 , ярко разгорается.
Азотная кислота действует почти на все металлы (за исключением золота, платины, тантала, родия, иридия), превращая их в нитраты, а некоторые металлы - в оксиды.
Концентрированная HNO 3 пассивирует некоторые металлы. Еще Ломоносов открыл, что железо, легко растворяющееся в разбавленной азотной кислоте, не растворяется в холодной концентрированной HNO 3 . Позже было установлено, что аналогичное действие азотная кислота оказывает на хром и алюминий. Эти металлы переходят под действием концентрированной азотной кислоты в пассивное состояние (см. § 100).
Степень окисленности азота в азотной кислоте равна +5. Выступая в качестве окислителя, HNO 3 может восстанавливаться до различных продуктов:
Какое из этих веществ образуется, т.е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрация HNO 3 , тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется NO 2 . При взаимодействии разбавленной азотной кислоты с малоактивными металлами, например с медью, выделяется NO. В случае более активных металлов - железа, цинка - образуется N 2 O. Сильно разбавленная азотная кислота взаимодействует с активными металлами - цинком, магнием, алюминием - с образованием иона аммония, дающего с кислотой нитрат аммония. Обычно одновременно образуются несколько продуктов.
Для иллюстрации приведем схемы реакций окисления некоторых металлов азотной кислотой :

При действии азотной кислоты на металлы водород, как правило, не выделяется.
При окислении неметаллов концентрированная азотная кислота, как и в случае металлов, восстанавливается до NO 2 , например:
Более разбавленная кислота обычно восстанавливается до NO, например:
Приведенные схемы иллюстрируют наиболее типичные случаи взаимодействия азотной кислоты с металлами и неметаллами. Вообще же, окислительно-восстановительные реакции, идущие с участием HNO 3 , протекают сложно.
Смесь, состоящая из 1 объема азотной и 3-4 объемов концентрированной соляной кислоты, называется царской водкой. Царская водка растворяет некоторые металлы, не взаимодействующие с азотной кислотой, в том числе и «царя металлов» - золото. Действие ее объясняется тем, что азотная кислота окисляет соляную с выделением свободного хлора и образованием хлороксида азота (III), или хлорида нитрозила, NOCl:

Хлорид нитрозила является промежуточным продуктом реакции и разлагается:
![]()
Хлор в момент выделения состоит из атомов, что и обусловливает высокую окислительную способность царской водки. Реакции окисления золота и платины протекают в основном согласно следующим уравнениям:
C избытком соляной кислоты хлорид золота (III) и хлорид платины (IV) образуют комплексные соединения Н[АиС1 4 ] и H 2 .
На многие органические вещества азотная кислота действует так, что один или несколько атомов водорода в молекуле органического соединения замещаются нитрогруппами - NO 2 . Этот процесс называется нитрованием и имеет большое значение в органической химии.
Электронная структура молекулы HNO 3 рассмотрена в § 44.
Азотная кислота - одно из важнейших соединений азота: в больших количествах она расходуется в производстве азотных удобрений, взрывчатых веществ и органических красителей, служит окислителем во многих химических процессах, используется в производстве серной кислоты по нитрозному способу, применяется для изготовления целлюлозных лаков, кинопленки.
Соли азотной кислоты называются нитратами. Все они хорошо растворяются в воде, а при нагревании разлагаются с выделением кислорода. При этом нитраты наиболее активных металлов переходят в нитриты:
Нитраты большинства остальных металлов при нагревании распадаются на оксид металла, кислород и диоксид азота. Например:
Наконец, нитраты наименее активных металлов (например, серебра, золота) разлагаются при нагревании до свободного металла:
Легко отщепляя кислород, нитраты при высокой температуре являются энергичными окислителями. Их водные растворы, напротив, почти не проявляют окислительных свойств.
Наиболее важное значение имеют нитраты натрия, калия, аммония и кальция, которые на практике называются селитрами.
Нитрат натрия NaNO 3 , или натриевая селитра , иногда называемая также чилийской селитрой, встречается в большом количестве в природе только в Чили.
Нитрат калия KNO 3 , или калийная селитра , в небольших количествах также встречается в природе, но, главным образом, получается искусственно при взаимодействии нитрата натрия с хлоридом калия.
Обе эти соли используются в качестве удобрений, причем нитрат калия содержит два необходимых растениям элемента: азот и калий. Нитраты натрия и калия применяются также при стекловарении и в пищевой промышленности для консервирования продуктов.
Нитрат кальция Ca(NO 3) 2 , или кальциевая селитра , получается в больших количествах нейтрализацией азотной кислоты известью; применяется как удобрение.
Нитрат аммония NH 4 NO 3 .
- Учащемуся рекомендуется самому составить полные уравнения этих реакций.