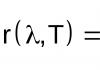Степень окисления (окислительное число, состояние окисления) - это. Чему равна степень окисления кислорода в Н2О2? Н2о2 степень окисления
Пероксид, или перекись водорода – кислородное соединение водорода (перекись). Формула: Н2О2 Физические свойства: перекись водорода – бесцветная сиропообразная жидкость, плотность – 1,45 г/см3относится к числу очень слабых, т. к. в очень малой степени диссоциирует: по I ступени:
по II ступени:
Химические свойства: при взаимодействии концентрированного раствора Н2О2 с гидроксидами металлов образуются их пероксиды: Na2O2, CaO, MgO2 идр.
Пероксиды, или перекиси – это соли Н2О2, состоящие из положительно заряженных ионов металлов и отрицательно заряженных ионов О22-, электронное строение их аниона следующее:
Н2О2 проявляет окислительно-восстановительные свойства: окисляет вещества стандартный электронный потенциал которых (Е°) не превышает 1,776 В; восстанавливает вещества у которых Е° больше 0,682 В. Окислительно-восстановительные свойства Н2О2 объясняются тем, что степень окисления -1 у атомов кислорода имеет промежуточное значение между степенями окисления -2 и 0. Более характерны для него окислительные свойства.
Н2О2 здесь выступает окислителем.

В этих случаях пероксид водорода является восстановителем.
Соли H2O2 – пероксиды (перекиси) также обладают окислительно-восстановительными свойствами:
Здесь Na2O2 – восстановитель.
Получение: в промышленности H2O2 получают взаимодействием разбавленной серной кислотой с пероксидом бария ВаО2: H2SO4(разб.) + ВаО2= ВаSO4 + H2O2, а также путем перегонки пергидроля в вакууме получается концентрированный пероксид водорода. Пергидроль – 30 %-ный водный раствор H2O2. Окислительная способность и безвредность применения пероксида водорода дала возможность широкого использования его во многих отраслях народного хозяйства: в промышленности – для отбеливания тканей, мехов; в пищевой промышленности – для консервирования продуктов; в сельском хозяйстве – для протравливания семян, в производстве ряда органических соединений, например, в производстве глицерина: промежуточный продукт при получении глицерина – аллиловый спирт СН2 = СН – СН2ОН окисляют при помощи H2O в глицерин С3Н5(ОН)3 , используется в ракетной технике как сильный окислитель. 3 %-ный H2O2 применяется в фармацевтике в медицинских целях как дезинфицирующее средство.
Молекула пероксида водорода имеет угловое строение (рис. 1). Энергия связи О-О (210кДж/моль) значительно меньше энергии связи О-Н (468 кДж/моль).
Рис. 1. Строение молекулы пероксида водорода с указанием валентных углов между связями и длин химических связей.
Вследствие несимметричного распределения связей Н-О молекула пероксида водорода сильно полярна (дипольным момент равен 0,7×10 -29 Кл×м). Между молекулами пероксида водорода возникает прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода - сиропообразная жидкость (плотность - 1,44 г/см 3), с довольно высокой температурой кипения (150,2 o C). Температура плавления равна 0,41 o C. Она имеет бледно-голубую окраску. Брутто-формула - H 2 O 2 . Молярная масса - 34 г/моль.
Пероксид водорода - хороший ионизирующий растворитель. С водой смешивается в любых соотношениях благодаря возникновению новых водородных связей. Из растворов выделяется в виде неустойчивого кристаллогидрата H 2 O 2 ×2H 2 O.
H2O2, степени окисления элементов в нем
Чтобы определить степени окисления элементов, входящих в состав пероксида водорода, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Пероксид водорода, как и вода, представляет собой гидрид кислорода, а которых водород, как известно, проявляет степень окисления (+1). Для нахождения степени окисления кислорода примем её значение за «х» и определим его при помощи уравнения электронейтральности:
2× (+1) + 2×х = 0;
Значит степень окисления кислорода в пероксиде водорода равна (-1):
H +1 2 O — 1 2 .
Примеры решения задач
ПРИМЕР 1
| Задание | В соединениях NH 4 Cl, LiClO 4 , Cl 2 O степень окисления хлора соответственно равна: |
| Решение | Для того, чтобы дать правильный ответ на поставленный вопрос будем поочередно определять степень окисления хлора в каждом из предложенных соединений с помощью уравнения электронейтральности.
а) Степень окисления азота в ионе аммония равна (-3), а водорода — (+1). Примем за «х» значение степени окисления хлора: (-3) + 4×1 + х = 0; б) Степень окисления лития всегда равна (+1). Степень окисления кислорода в данном случае равна (-2). Примем за «х» значение степени окисления хлора: 1 + х + 4×(-2) = 0; в) Степень окисления кислорода в оксидах всегда равна (-2). Примем за «х» значение степени окисления хлора: 2×х + (-2) = 0; Следовательно, последовательность степеней окисления хлора в соединениях будет следующей: -1, +7, +1. |
| Ответ | Вариант (г) |
ПРИМЕР 2
| Задание | Степень окисления (+5) азот проявляет в соединении: а) N 2 O 3 ; б) (NH 4) 2 SO 4 ; в) KNO 2 ; г) Fe(NO 3) 3 ? |
| Решение | Для того, чтобы дать верный ответ будем поочередно определять степень окисления азота в каждом из предложенных соединений при помощи уравнения электронейтральности.
а) Степень окисления кислорода в оксидах всегда равна (-2). Примем за «х» степень окисления азота: 2×х + 3×(-2) =0; Ответ неверный. б) Степень окисления серы в сульфат-анионе равна (+6), кислорода и водорода - (-2) и (+1) соответственно. Примем за «х» степень окисления азота: 2×х + 8×1 + 6 + 4×(-2) =0; Ответ неверный. в) Степень окисления калия всегда равна (+1). Степень окисления кислорода в данном случае равна (-2). Примем за «х» степень окисления азота: 1 + х + 2×(-2) =0; Ответ неверный. г) Степень окисления железа в данном случае равна (+3), кислорода - (-2). Степень окисления кислорода в данном случае равна (-2). Примем за «х» степень окисления азота: 3 + 3×х + 9×(-2) =0; Верный ответ. |
| Ответ | Вариант (г) |
условный заряд атома в молекуле, вычисленный согласно предположению, что молекула состоит только из ионов.
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
1. Кислороду в химических соединениях всегда приписывают степень окисления -2 (исключение составляют фторид кислорода OF 2 и пероксиды типа Н 2 О 2 , где кислород имеет степень окисления соответственно +2 и -1).
2. Степень окисления водорода
в соединениях считают равной +1 (исключение:
в гидридах, например, в Сa +2 Н 2 -1).
3.
Металлы во всех соединениях имеют положительные значения степени
окисления.
4. Степень окисления нейтральных молекул и атомов (например, H 2 , С и др.) равна нулю, так же как и металлов в свободном состоянии.
5. Для элементов, входящих в состав сложных веществ, степень окисления
находят алгебраическим путём. Молекула нейтральна,
следовательно, сумма
всех зарядов равна нулю. Например, в случае H 2 +1 SO 4 -2 составляем уравнение с
одним неизвестным для определения степени окисления серы:
2(+1) + х + 4(-2) = 0, х-6 = 0, х = 6.
Реакции, в результате которых изменяется степень окисления элементов, называются окислительно-восстановительными.
Основные положения теории ОВР
1) Окислением
называют процесс отдачи
электронов атомом, молекулой или
ионом. Степень окисления при этом повышается.
Например, А1 - 3е – Аl + 3 .
2) Восстановлением
называют процесс присоединения
электронов атомом,
молекулой или ионом. Степень окисления при этом понижается.
Например,
S + 2e= S -2 .
3) Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями.
4) Окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
восстановитель - е↔окислитель; окислитель + е↔восстановитель.
Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления.
Процессы окисления и восстановления выражают электронными уравнениями. В них указываются изменение степени окисления атомов и число электронов, отданных восстановителем и принятых окислителем. Так, для реакции
2К +1 I -1 + 2Fe +3 Cl 3 -1 = I 2 0 + 2Fe +2 Cl 2 -1 + 2K +1 Cl -1 электронные уравнения имеют вид
2I -1 - 2е = I 2 0 процесс окисления (восстановитель); Fe +3 + е = Fe +2 процесс восстановления (окислитель).
Для составления уравнений окислительно-восстановительных реакций применяют два метода: метод электронного баланса и ионно-электронный метод (метод полуреакций).
Метод электронного баланса является универсальным. В этом методе сравнивают степени окисления атомов в исходных и конечных веществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединённых окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путём, либо на основании известных свойств элементов.
Ионно-электронный метод (метод полуреакций) использует представления об электролитической диссоциации. Метод применяют только при составлении уравнений ОВР, протекающих в растворе. В отличие от метода электронного баланса данный метод даёт более правильное представление о процессах окисления - восстановления в растворах, так как рассматривает ионы и молекулы в том виде, в котором они существуют в растворе. Слабые электролиты или малорастворимые вещества записывают в виде молекул, а сильные - в виде ионов. При этом учитывают, что в водной
среде в реакции могут участвовать ионы Н + , ОН - и молекулы Н 2 О. Правила нахождения коэффициентов в уравнениях ОВР, протекающих в кислой, щелочной и нейтральной средах, неодинаковы.
Если реакция среды кислая
Правило. Каждая связывается с двумя ионами водорода с образованием одной молекулы воды:
[О -2 ] + 2Н + = Н 2 О.
Каждая берётся из молекулы воды, при этом освобождается два иона водорода: Н 2 О - [О -2 ] = 2Н + .
Если реакция среды щелочная
Правило. Каждая освобождающаяся частица кислорода реагирует с одной молекулой воды, образуя два гидроксид-иона: [О -2 ] + Н 2 О = 2ОН - .
Каждая недостающая частица кислорода берётся из двух гидроксид-ионов с образованием одной молекулы воды: 2ОН - - [О -2 ] = Н 2 О.
Если реакция среды нейтральная
Правило. Каждая освобождающаяся частица кислорода взаимодействует с одной молекулой воды, образуя два гидроксид-иона: [О -2 ] + Н 2 О = 2ОН - .
Каждая недостающая частица кислорода берётся из молекулы воды с образованием двух ионов водорода: Н 2 О - [О -2 ] = 2Н + .
Подбор коэффициентов ОВР ионно-электронным методом проводится в несколько этапов:
1) записать схему реакции (реакция среды кислая) в молекулярной форме,
например:
KMnO 4 + Na 2 SO 3 + H 2 SO 4 = MnSO 4 + Na 2 SO 4 + K 2 SO 4 + H 2 O;
2) записать схему реакции в ионной форме и определить ионы и молекулы, которые изменяют степень окисления:
К + + МпО 4 - + 2Na + + SO 3 2- + 2H + + SO 4 2- = Mn 2+ + SO 4 2- + 2Na + + SO 4 2- +
2K + + SO 4 2- + H 2 O;
3) составить ионно-электронные уравнения с участием выделенных ионов
и молекул, учитывая, что количество атомов кислорода уравнивают, используя
молекулы воды или ионы водорода.
Для данной реакции:
Недостаток атомов кислорода в кислой среде берётся из молекулы воды:
SO 3 2- + H 2 O - 2е - = SO 4 2- + 2Н + ;
Избыток атомов кислорода в кислой среде
связывается ионами водорода в
молекулы воды:
MnO 4 - + 8H + + 5е - = Мn 2+ + 4Н 2 О;
4) умножить полученные уравнения на наименьшие множители для баланса по электронам:
SO 3 2- + Н 2 О - 2е - = SO 4 2- + 2H + | 5 МпО 4 - + 8Н + + 5е - = Mn 2+ +4H 2 O | 2
5SO 3 2- + 5H 2 O – l0e - = 5SO 4 2- + 10H + 2MnO 4 - + 16H + + 10e - = 2Mn 2+ +8H 2 O;
5) суммировать полученные электронно-ионные уравнения:
5SO 3 2- + 5Н 2 О - 10е - + 2MnO 4 - + 16H + + 10e - = 5SO 4 2- + 10H + + 2Mn 2+ + 8H 2 O;
6) сократить подобные члены и получить ионно-молекулярное уравнение
ОВР:
5SO 3 2- + 2МпО 4 - + 6Н + = 5SO 4 2- + 2Мn 2+ + 3Н 2 О;
7) по полученному ионно-молекулярному уравнению составить молекулярное уравнение реакции:
2KMnO 4 + 5Na 2 SO 3 + 3H 2 SO 4 = 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O.
Окислительно-восстановительные реакции разделяют на три типа:
1) Межмолекулярные - это реакции, в которых окислитель и восстановитель находятся в разных веществах:
2Н 2 8 +6 O 4 (конц.) + Сu 0 = Cu +2 SO 4 + S +4 O 2 + 2Н 2 О.
2) Внутримолекулярные - это реакции, в которых окислитель и восстановитель находятся в одной молекуле (атомы разных элементов):
2КС1 +5 О 3 -2 = 2КСl -1 + 3О 2 °
3) Диспропорционирование (реакции самоокисления-самовосстановления)
-
это реакции, в которых окислителем и восстановителем являются атомы
СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В каком из соединений кислород проявляет положительную степень окисления: Н2О; Н2О2; СО2; ОF2?
OF2. этом соединении кислород имеет степень окисления + 2
Какое из веществ является только восстановителем: Fe; SO3; Cl2; HNO3?
оксид серы (IV) - SO 2
Какой элемент в III периоде Периодической системы Д.И. Менделеева, будучи в свободном состоянии, является самым сильным окислителем: Na; Al; S; Сl2?
Сl хлор
V -часть
К каким классам неорганических соединений относятся следующие вещества: HF, PbO2, Hg2SO4, Ni(OH)2, FeS, Na2CО3?
Сложные вещества. Оксиды
Составьте формулы: а) кислых калиевых солей фосфорной кислоты; б) основной цинковой соли угольной кислоты Н2СО3.
Какие вещества получаются при взаимодействии: а) кислот с солью; б) кислот с основанием; в) соли с солью; г) основания с солью? Приведите примеры реакций.
А) оксиды металлов, соли металлов.
В) соли (только в растворе)
Г) образуется новая соль, нерастворимое основание и водород
С какими из перечисленных ниже веществ будет реагировать соляная кислота: N2O5, Zn(OH)2, CaO, AgNO3, H3PO4, H2SO4? Составьте уравнения возможных реакций.
Zn(OH)2 + 2 HCl = ZnCl + H2O
CaO + 2 HCl = CaCl2 + H2O
Укажите, к какому типу оксидов относится оксид меди, и докажите это с помощью химических реакций.
Оксид метала.
Оксид меди (II) CuO – кристаллы черного цвета, кристаллизуются в моноклинной сингонии, плотность 6,51 г/см3, температура плавления 1447°С (под давлением кислорода). При нагревании до 1100°С разлагается с образованием оксида меди (I):
4CuO = 2Cu2O + O2.
В воде не растворяется и не реагирует с ней. Имеет слабовыраженные амфотерные свойства с преобладанием основных.
В водных растворах аммиака образует гидроксид тетраамминмеди (II):
CuO + 4NH3 + H2O = (OH)2.
Легко реагирует с разбавленными кислотами с образованием соли и воды:
CuO + H2SO4 = CuSO4 + H2O.
При сплавлении со щелочами образует купраты:
CuO + 2KOH = K2CuO2 + H2O.
Восстанавливается водородом, угарным газом и активными металлами до металлической меди:
CuO + H2 = Cu + H2O;
CuO + CO = Cu + CO2;
CuO + Mg = Cu + MgO.
Получается при прокаливании гидроксида меди (II) при 200°С:
Cu(OH)2 = CuO + H2OПолучение оксида и гидроксида меди (II)
или при окислении металлической меди на воздухе при 400–500°С:
2Cu + O2 = 2CuO.
6. Закончите уравнения реакций:
Mg(OH)2 + H2SO4 = MgSO4+2H2O
Mg(OH)2^- +2H^+ + SO4^2-=Mg^2+ + SO4^2- +2H2O
Mg(OH)2^- +2H^+ = Mg^2+ +2H2O^-
NaOH + Н3РО4 = NaH2PO4+H2O ФЭ=1
Н3РО4+2NaOH=Na2HPO4+2H2O ФЭ =1/2
Н3РО4+3NaOH=Na3PO4+3H2O ФЭ =1/3
в первом случае 1 моль фосфорной кислоте гм.. . эквивалентен 1 протону.. . значит, фактор эквивалентности 1
процентная концентрация - масса вещества в граммах, содержащаяся в 100 граммах раствора. если в 100 г раствора содержится 5 г соли, сколько надо для 500 г?
титр - масса вещества в граммах, содержащаяся в 1 мл раствора. 0,3 г хватит на 300 мл.
Са(ОН)2 + Н2СО3 = СаО + Н2О 2/ характерная реакция - реакция нейтрализации Са/ОН/2 + Н2СО3 = СаСО3 + Н2О 3/ реагируют с кислотными оксидами Са/ОН/2 +СО2 = СаСО3 +Н2О 4/ с кислыми солями Са/ОН/2 + 2КНСО3 = К2СО3 +СаСО3 + 2Н2О 5/ щелочи вступают в обменную реакцию с солями. если при этом образуется осадок 2NaOH + CuCl2 = 2NaCl + Cu/OH/2 /осадок/ 6/ растворы щелочей реагируют с неметаллами.а также с алюминие или цинком. ОВР.
Назовите три способа получения солей. Ответ подтвердите уравнениями реакций
А)Реакция нейтрализации .. После выпаривания воды получают кристаллическую соль. Например:
Б)Реакция оснований с кислотными оксидами (см. параграф 8.2). Это также вариант реакции нейтрализации:
В)Реакция кислот с солями . Этот способ подходит, например, в том случае, если образуется нерастворимая соль, выпадающая в осадок:
Какие из перечисленных ниже веществ могут реагировать между собой: NaOH, H3PO4, Аl(ОН)3, SО3, H2О, СаО? Ответ подтвердите уравнениями реакций
2 NaOH + H3PO4 =Na2HPO4 + 2H2O
CaO + H2O = Ca(OH)2
Al(OH)3 +NaOH = Na{Al(OH)4} или NaAlO2 + H2O
SO3 + H2O = H2SO4
VI- часть
Ядро атома (протоны, нейтроны).
Атом - это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра, имеющего положительный электрический заряд, и отрицательно заряженных электронов. Заряд ядра любого химического элемента равен произведению Z на e, где Z - порядковый номер данного элемента в периодической системе химических элементов, е - величина элементарного электрического заряда.
Протоны - стабильные элементарные частицы, имеющие единичный положительный электрический заряд и массу, в 1836 раз большую, чем масса электрона. Протон представляет собой ядро атома самого легкого элемента - водорода. Число протонов в ядре равно Z. Нейтрон - нейтральная (не имеющая электрического заряда) элементарная частица с массой, очень близкой к массе протона. Поскольку масса ядра складывается из массы протонов и нейтронов, то число нейтронов в ядре атома равно А - Z, где А - массовое число данного изотопа (см. Периодическая система химических элементов). Протон и нейтрон, входящие в состав ядра, называются нуклонами. В ядре нуклоны связаны особыми ядерными силами.
Электроны
Электрон - мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10 -19 кулона, принятым за элементарный электрический заряд. Электроны, вращаясь вокруг ядра, располагаются на электронных оболочках К, L, М и т. д. К - оболочка, ближайшая к ядру. Размер атома определяется размером его электронной оболочки.
Изотопы
Изотоп - атом одного и того же химического элемента, ядро которого имеет то же число протонов (положительно заряженных частиц) , но разное количество нейтронов, а сам элемент имеет тот же атомный номер, что и основной элемент. В силу этого изотопы имеют различные атомные массы.
Как находить степень окисления элемента? и получил лучший ответ
Ответ от
СТЕПЕНИ ОКИСЛЕНИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ.
Мы уже знаем о существовании заряженных частиц-ионов. Положительный заряд иона равен числу электронов, отданных одним атомом элемента; отрицательный заряд иона равен числу электронов, принятых одним атомом элемента. Записи Na+, Ca2+, Al3+ означают, что атомы данных элементов потеряли соответственно 1, 2, 3 е-, а записи F-, O2-, N3- означают, что атомы данных элементов приобрели соответственно 1, 2, и 3е- .
Степени окисления элементов. Для определения состава молекулярных соединений (SO2, NH3, CO2 и т. д.) и ионных простых соединений (Na2O, Na2SO4 и т. д.). При оценке степени окисления элементов соединения представляют расщеплёнными на одноатомные ионы.
Степень окисления-это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, причём знак ставится перед числом: -1, -2, +3, в отличии от заряда иона, где знак ставится после числа.
В молекулах алгебраическая сумма степеней окисления элементов с учётом числа их атомов равна 0.
Степени окисления металлов в соединениях всегда положительные, высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключая некоторые элементы: золото Au+3 (I группа) , Cu+2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru.
Степени неметаллов могут быть как положительными так и отрицательными, в зависимости от того с каким атомом он соединён: если с атомом металла то всегда отрицательная, если с неметаллом-то может быть и +, и - (об этом вы узнаете при изучении ряда электроотрицательностей). Высшую отрицательную степень окисления неметаллов можно найти, вычтя из 8 номер группы, в которой находится данный элемент, высшая положительная равна числу электронов на внешнем слое (число электронов соответствует номеру группы) .
Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
При определении степеней окисления необходимо использовать следующие правила:
1.Элемент в простом веществе имеет нулевую степень окисления;
2.Все металлы имеют положжительную степень окисления;
3.Бор и кремний в соединениях имеют положительные степени окисления;
4.Водород имеет в соединениях степень окисления (+1).Исключая гидриды (соединения водорода с металлами главной подгруппы первой-второй групп, степень окисления -1, например Na+H-);
5.Кислород имеет степень окисления (-2),за исключением соединения кислорода со фтором O+2F-2 и в перекисях (Н2О2 - степень окисления кислорода (-1);
6.Фтор имеет степень окисления (-1)
Приведу таблицу, где указаны постоянные степени для наиболее часто используемых элементов: Степени окисления Элементы
+1Li, Na, K, Rb, Cs, Ag, H (кроме гидридов)
+2Be, Mg, Ca, Sr, Zn, Cd, Ba
+3Al, B
-1F,{ Cl, Br, I-если соединены с водородом или металлами}
-2O,{ S, Se, Te-в соединениях с водородом и металлами}
-3{N, P, As}-в соединениях с водородом и металлами
Порядок определения степеней окисления в соединениях. Пример. Определить степени окисления в соединении K2Cr2O 7 .
У двух химических элементов калия и кислорода степени окисления постоянны и равны соответственно +1 и -2. Число степеней окисления у кислорода равна (-2)·7=(-14), у калия (+1)·2=(+2). Число положительных степеней окисления равно числу отрицательных. Следовательно (-14)+(+2)=(-12). Значит у атома хрома число положительных степеней равно 12, но атомов 2, значит на один атом приходится (+12):2=(+6), записываем степени окисленя над элементами К+2Cr+62O-27